
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Biết 1 lít hỗn hợp A ở dạng khí nặng gấp hai lần 1 lít khí C 2 H 6 ở cùng điều kiện.
⇒ n A = n C 2 H 6 ⇒ M A = 2 M C 2 H 6
(cùng điều kiện nên tỉ lệ thể tích chính là tỉ lệ số mol)
Ba chất có cùng công thức phân tử ⇒ có cùng khối lượng mol phân tử : M = 2.30 = 60 (gam/mol). Khi đốt cháy hỗn hợp A thu được CO 2 , H 2 O → công thức phân tử của các chất có dạng C x H y O z
Phương trình hoá học
C x H y O z + (x + y/4 - z/2) O 2 → x CO 2 + y/2 H 2 O
CO 2 + Ca OH 2 → Ca CO 3 + H 2 O
Ta có : n CO 2 = n CaCO 3 = 15/100 = 0,15mol
Theo định luật bảo toàn khối lượng, ta có :
m A + m O = m CO 2 + m H 2 O
⇒ 3 + 7,2 = 0,15 x 44 + m H 2 O ⇒ m H 2 O = 3,6g
n A = 3/60 = 0,05mol; n CO 2 = 0,05x = 0,15 ⇒ x = 3
n H 2 O = 0,05y/2 = 3,6/18 ⇒ y = 8
M A = 12x + y + 16z = 60 ⇒ z = 1 ⇒ ông thức phân tử của A là C 3 H 8 O
Công thức cấu tạo của ba chất là : CH 3 CH 2 CH 2 OH
CH 3 CHOH CH 3
CH 3 -O- CH 2 CH 3

Vì hợp chất A đốt cháy bằng oxi thu được sản phẩm chỉ gồm CO2 và H2O
Nên A gồm 3 nguyên tố C, H và O
gọi CTHH là CxHyOz
PTHH
CxHyOz + \(\left(x+\frac{y}{4}-\frac{z}{2}\right)\) O2 ----> xCO2 + \(\frac{y}{2}\) H2O ( 1 )
0,05 ----\(\left(x+\frac{y}{4}-\frac{z}{2}\right)0,05\)----0,05x
Ca(OH)2 + CO2 ---> CaCO3 + H2O
Có n CaCO3 = 15/100 = 0,15 ( mol )
=> n CO2 = 0,15 ( mol )
Vì 1 lít hỗn hợp dạng khí nặng gấp 2 lần 1 lít khí C2H6 cùng tiêu chuẩn
=> \(\hept{\begin{cases}n_{CxHyOz}=n_{C2H6}\\m_{CxHyOz}=2m_{C2H6}\end{cases}}\)
=> M CxHyOz = 2M C2H6
=> M CxHyOz = 2 . 30 = 60 => 12x + y + 16z = 60
=> n CxHyOz = 3/60 = 0,05 ( mol )
Theo ( 1 ) : 0,05x = 0,15 => x = 3
Do đó y + 16z = 60 - 12x3 = 24 ( 2 )
Có n O2 = 7,2 : 32 = 0,225 ( mol )
=> \(\left(x+\frac{y}{4}-\frac{z}{2}\right)0,05=0,225\)
\(\Rightarrow x+\frac{y}{4}-\frac{z}{2}=4,5\)
\(\Rightarrow\frac{y}{4}-\frac{z}{2}=4,5-3=1,5\)
\(\Rightarrow y-2y=6\) ( 3 )
Theo ( 2 ) và ( 3 ) ta có hpt
\(\hept{\begin{cases}y+16z=24\\y-2z=6\end{cases}\Rightarrow\hept{\begin{cases}y=8\\z=1\end{cases}}}\)
Vậy CT là C3H8O

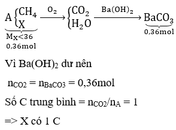
a) MX = 146g/mol
VCO2 : VH2O = 6 : 5
=> nC : nH = 3 : 5
=> CTĐGN: (C3H5Oa)n
→ (41 + 16a).n = 146 → (a; n) = (4; 2) → X: C6H10O4
b) C6H10O4 + 6,5O2 → 6CO2 + 5H2O
0,05 0,325
=> p = 7,3g
c)
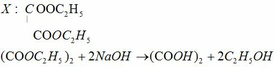

a)

CxH2x +2 + (3x+1)/2O2 → t ∘ x CO2 + (x+1) H2O
CyH2y + 3y/2O2 → t ∘ y CO2 + y H2O
CzH2z-2 + (3z-1)/2O2 → t ∘ zCO2 + (z-1) H2O
Khi đốt cháy hỗn hợp A thu được CO2 và H2O. Cho sản phẩm qua Ca(OH)2 dư thì khối lượng bình tăng chính là khối lượng của H2O và CO2
=> mCO2 + mH2O = 9,56 (g)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 16/100 = 0,16 (mol)
=> nH2O = (9,56 – 0,16.44)/18 = 0,14 (mol)
Ta có hệ phương trình:
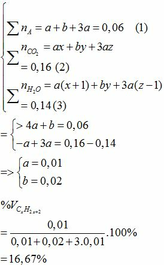
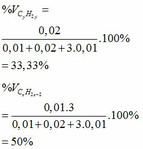
b)
thế a, b vào (2) => 0,01x + 0,02y + 3.0,01z = 0,16
=> x + y +3z = 16
Vì có 2 hidrocacbon bằng nhau và bằng một nửa số cacbon của hidrocacbon còn lại nên có các trường hợp sau:
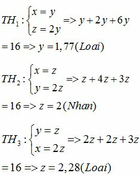
Vậy công thức phân tử của 3 hidrocacbon là: C2H6; C2H4 và C2H2

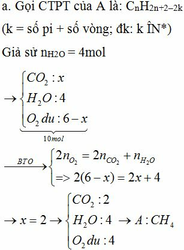
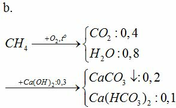
pt:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,3 → 0,3 0,3
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,1 → 0,1 0,1
m dd tăng = mCO2 + mH2O – mCaCO3 = 12g

\(m_{CO_2} + m_{H_2O}=m_{BaCO_3} -m_{giam}=19,7-5,5=14,2\)
Do đun nóng tạo kết tủa nên phản ứng với Ba(OH)2 tạo 2 muối.
\(Ba(HCO_3)_2 \to BaCO_3 + CO_2 + H_2O\)
0,05<-----------------------------0,05
Bảo toàn cacbon:\( n_{CO_2}=n_{C}=n_{BaCO_3}+2n_{Ba(HCO_3)_2}=0,2\) (mol)
\(\Rightarrow n_{H_2O}=\dfrac{14,2-0,2.44}{18}=0,3\) (mol)
Vì \(n_{H_2O}>n_{CO_2}\Rightarrow\) Chất X không có liên kết pi trong phân tử.
Bảo toàn Oxi: \(n_{O_X}=2n_{CO_2}+n_{H_2O}-2n_{O_2}=0,1\) (mol)
\(n_C:n_H:n_O=2:6:1\)
\(\Rightarrow\)CTPT dạng \((C_2H_6O)_n\)
Trong hợp chất hữu cơ chứa C, H, O ta luôn có:
0 < H ≤ 2C + 2
⇒ 0 < 6n ≤ 2.2n + 2
⇒ 0 < n ≤ 1
⇒ n = 1
Vậy CTPT của X là C2H6O.