Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì tỉ lệ số mol của M và Fe trong A là 2:3.
=> Gọi số mol là 2a mol M và 3a mol Fe
Gọi hóa trị của kim loại M là n
Phần 1:
3Fe + 2O2 → Fe3O4
3a------------------->a
4M + 3O2 → 2M2O3
2a------------------->a
Phần 2:
Fe + 2HCl → FeCl2 + H2
3a ------------------------------->3a
M + nHCl → MCln + \(\dfrac{n}{2}\)H2
2a -----------------------> a.n
=> 3a + a.n = \(\dfrac{26,88}{22,4}\) = 1,2 (*)
Phần 3:
2Fe + 3Cl2 → 2FeCl3
3a ----> \(\dfrac{9}{2}\)a
2M + nCl2 → 2MCln
2a -----> n.a
=> \(\dfrac{9}{2}\)a + n.a = \(\dfrac{33,6}{22,4}\) = 1,5 (**)
Từ (*) và (**) => a = 0,2 và n = 3
Ta có : 0,2.232 + 0,2(2M + 16.3) = 66,8
=> M = 27 (g/mol)
=> Kim loại M là nhôm (Al)
=> m Al ban đầu = 0,4.27.3= 32,4 (g)
mFe ban đầu = 0,6.56.3 = 100,8 (g)

Mỗi phần có 2a mol M, 3a mol Fe
- P2: \(n_{Cl}=n_{HCl}=2n_{H2}=2,4\left(mol\right)\)
- P3:\(n_{Cl}=2n_{Cl2}=3\left(mol\right)\)
\(FeCl_2+Cl\rightarrow FeCl_3\)
Lượng Cl tăng lên của P3 so với P2:
\(3-2,4=0,6\left(mol\right)=n_{FeCl2}=n_{Fe}\)
\(\Rightarrow3a=0,6\)
\(\Rightarrow a=0,2\Rightarrow n_M=0,4\left(mol\right)\)
- P1: Thu đc 2 oxit M2Ox (0,2 mol) và Fe3O4 (0,2 mol)
\(\Rightarrow\left(2M+16x\right).0,2+232.0,2=66,8\)
\(\Rightarrow2M+16x=102\)
\(x=3\Rightarrow M=27\)
Vậy M là Al
\(\%m_{Al}=\frac{0,4.27.100}{0,4.27+0,6.56}=24,32\%\)
\(\%m_{Fe}=100\%-24,32\%=75,68\%\)

gọi hóa trị của M là n
p2:
Fe--> Fe+2 + 2e
x------------------>2x
M--> M+n + ne
y----------------->yn
2x+ yn= 1,2*2
P3
Fe--> Fe+3 + 3e
M--> M+n + ne
3x+ yn= 1,5*2
--> x=0,6, y=0,4
--> n=3--> ox M là M2O3
mM2O3=66,8- 232*0,2= 20,4
--> M(M2O3)=102--> M=27: Al
mFe=100,8
mAl=32,4

1.
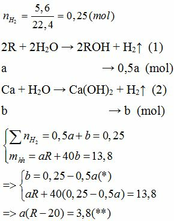
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
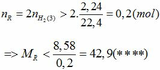
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
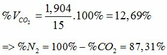
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
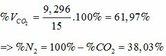

a)Thí nghiệm 2 :
$2R + O_2 \xrightarrow{t^o} 2RO$
n O2 = 1,12/22,4 = 0,05(mol)
n R < 2 n O2 = 0,1(mol)
=> R > 3/0,1 = 30(1)
Thí nghiệm 2 : n H2 = 5,6/22,4 = 0,25(mol)
n R = a(mol)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$R + H_2SO_4 \to RSO_4 + H_2$
n Fe = 0,25 - a(mol)
Suy ra :
(0,25 - a).56 + Ra = 11,6
=> R = (56a - 2,4)/a
Mà 0 < a < 0,25
Suy ra : R < 46,6(2)
Từ (1)(2) suy ra : 30 < R < 46,6
Suy ra R là Ca(R = 40)
b) (0,25 -a)56 + 40a = 11,6
=> a = 0,15
%m Ca = 0,15.40/11,6 .100% = 51,72%
%m Fe = 100% -51,72% = 48,28%

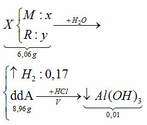
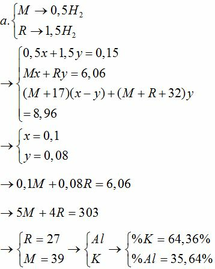
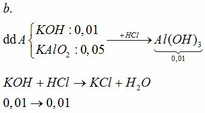
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml

phần 1:
Fe[0]--->Fe[+2] + 2e
x------------------------2xmol
R[0]----->R[+n] + ne
y---------------------->yn mol
2H[+] + 2e---->H2[0] (nH2=0.095 mol)
----------0.19<----0.095mol
====> theo đl bảo toàn e: 2x + yn= 0.19 mol (1)
Phần 2:
Fe[0]---->Fe[+3] + 3e
x------------------------->3x mol
R[0]----->R[+n] + ne
y---------------------->yn mol
N[+5] + 3e---->N[+2] ( nNO= nN[+2] =0.08 mol)
-----------0.24<----0.08mol
====>theo đl bảo toàn e: 3x + yn=0.024 (2)
Lấy (2) trừ (1) ta được: x=0.05mol
**** Cả hai phần R phản ứng đều ở mức oxh [+n] nên em không cần quan tâm đến nó. Nếu đây là bài toán trắc nghiệm em có thể tính nhanh số mol Fe mỗi phần bằng cách ( khỏi phải viết mấy cái quá trình như trên dài lắm em nhá) :
n Fe = ( 3nNO) - (2nH2) =0.05 mol
Khối lượng mỗi phần = 7.22/2=3.61 g
=>m(R)= 3.61 - (0,05*56)=0.81 g
=>%mR= 0.81/3.61=22,4%
thế các số liệu vào ( phần 1)
Fe[0] -----.Fe[+2] + 2e
0.05------------------------0.1mol
R[0] -----R[+n] + ne
0.81/R--------------0.81n/R
2H[+] + 2e---->H2[0]
----------0.19<----0.095mol
Theo đl bảo toàn e: 0.1 + 0.81n/R = 0.19
=>R=9n
n=1 ==>R= 9 (l)
n=2 ==>R= 18(l)
n=3 ==>R=27( nhận)
.....
Vậy R là Al
Gọi hóa trị của R là n
Số mol của Fe, R trong từng phần là 3a, 2a
Phần 2:
Ta có :
\(\text{nH2 = 26,88 : 22,4 = 1,2 mol}\)
\(\text{Fe + 2HCl → FeCl2 + H2↑}\)
3a......................................3a.......(mol)
\(\text{2R + 2nHCl → 2RCln + nH2↑}\)
2a............................................na.............(mol)
\(\text{nH2 = 3a + na = 1,2 mol (1)}\)
Phần 3:
\(\text{nCl2 = 33,6 : 22,4 = 1,5 mol}\)
\(\text{2Fe + 3Cl2 → 2FeCl3}\)
3a.........4,5a.......................(mol)
\(\text{2R + nCl2 → 2RCln }\)
2a.........an.....................(mol)
\(\text{nCl2 = 4,5a + an = 1,5 mol (2)}\)
Từ (1) và (2) → a = 0,2; an = 0,6
→ n = 3
Phần 1:
\(\text{nFe = 0,6mol; nR = 0,4 mol}\)
\(\text{3Fe + 2O2 → Fe3O4}\)
0,6.......................0,2.............(mol)
\(\text{4R + 3O2 → 2R2O3}\)
0,4...................0,2..................(mol)
\(\text{mFe3O4 + mR2O3 = 66,8}\)
→ 0,2 . 232 + 0,2 . (2.MR + 48) = 66,8
→ MR = 27
→ R là nhôm
Trong hỗn hợp A có:
\(\text{mFe = 0,6 . 56 . 3 = 100,8(g)}\)
\(\text{mAl = 0,4 . 27 . 3 = 32,4(g)}\)