Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

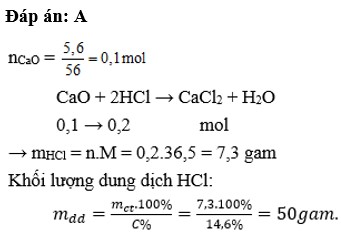
$n_{CaO} = \dfrac{5,6}{56} =0,1(mol)$
$CaO + 2HCl \to CaCl_2 + H_2O$
Theo PTHH :
$n_{HCl} = 2n_{CaO} = 0,2(mol) \Rightarrow m_{dd\ HCl} = \dfrac{0,2.36,5}{14,6\%} = 50(gam)$

Câu 22 : Trong hơi thở, Chất khí làm đục nước vôi trong là:
A. CO2 B. SO2. C. SO3. D. NO2
Câu 23 : Hòa tan hết 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là :
A. 40g B. 60g C. 73g. D. 50g
Câu 24 : Oxit của một nguyên tố hóa trị (II) chứa 28,57% oxi về khối lượng . Nguyên tố đó là:
A. Mg B. Ca C. Fe. D. Cu
Câu 25 : Để thu được 5,6 tấn vôi sống với hiệu suất phản ứng đạt 95% thì lượng CaCO3 cần dùng là :
A. 9 Tấn B. 10 Tấn C. 9,5 Tấn D. 10,5 Tấn
Câu 26 : Để loại bỏ khí CO2 có lẫn trong hỗn hợp (O2,CO2) , người ta cho hỗn hợp đi qua dung dịch chứa:
A. NaCl B. HCl C. Na2SO4. D. Ca(OH)2
Câu 27 : Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ba(OH)2 dư. Khối lượng chất kết tủa thu được là
A. 19,7g B. 19,3g C. 19,5g. D. 19g
Câu 28 : Hòa tan 12,6 gam natrisunfit vào dung dịch axit clohidric dư. Thể tích khí SO2 thu được ở đktc là:
A. 4,48 lít B. 2,24 lít C. 3,36 lít. D. 1,12 lít
Câu 29 : Hòa tan hết 11,7g hỗn hợp gồm CaO và CaCO3 cần 100 ml dung dịch HCl 3M . Khối lượng muối thu được là :
A. 16,65g B. 166,5g C. 15,56g. D. 155,6g
Câu 30 : Cho 20 gam hỗn hợp X gồm CuO và Fe2O3 tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của CuO và Fe2O3 trong hỗn hợp X lần lượt là
A. 25% và 75% B. 20% và 80%
C. 22% và 78% D. 30% và 70%
Câu 25
Phương trình phản ứng:
CaCO3 → CaO + CO2
100 56
10 tấn 5,6 tấn
Khối lượng theo lí thuyết là 10 tấn nhưng vì hiệu suất chỉ đạt 95% nên khối lượng thực tế cần phải lớn hơn 10 tấn
Ta có:
m=10:95%=10,5(tấn)

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{13}{65}=0,2mol\)
PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
TL: 1 : 2 : 1 : 1
mol: 0,2 \(\rightarrow\) 0,1 \(\rightarrow\) 0,2 \(\rightarrow\) 0,2
đổi 500ml = 0,5 l
\(a.C_{M_{ddHCl}}=\dfrac{n_{HCl}}{V_{HCl}}=\dfrac{0,1}{0,5}=0,2M\)
\(b.m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
c.
Màu của quỳ tím sẽ chuyển sang màu đỏ.
Giải thích:
- Phản ứng giữa axit HCl và bazơ KOH tạo ra muối KCl và nước: HCl + KOH → KCl + H2O
- Vì dung dịch KOH là bazơ, nên khi phản ứng với axit HCl thì sẽ tạo ra dung dịch muối KCl và nước.
- Muối KCl không có tính kiềm, nên dung dịch thu được sẽ có tính axit.
- Khi cho mẫu quỳ tím vào dung dịch axit, quỳ tím sẽ chuyển sang màu đỏ do tính axit của dung dịch.
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2----->0,4------>0,2---->0,2
a) \(C_{MddHCl}=\dfrac{0,4}{0,5}=0,8M\)
b) \(m_{muối}=m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{KOH}=\dfrac{5,6\%.200}{100\%.56}=0,2\left(mol\right)\)
Pt : \(KOH+HCl\rightarrow KCl+H_2O\)
0,2 0,4
Xét tỉ lệ : \(0,2< 0,4\Rightarrow HCldư\)
Khi cho quỳ tím vào dụng dịch sau phản ứng --> quỳ hóa đỏ (do HCl có tính axit)

Câu 4 :
\(n_{H2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a) Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,05 0,1 0,05
\(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,2 0,4
b) \(n_{Mg}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(m_{Mg}=0,05.24=1.2\left(g\right)\)
\(m_{MgO}=9,2-1,2=8\left(g\right)\)
c) Có : \(m_{MgO}=8\left(g\right)\)
\(n_{MgO}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,1+0,4=0,5\left(mol\right)\)
\(m_{HCl}=0,05.36,5=18,25\left(g\right)\)
\(m_{ddHCl}=\dfrac{18,25.100}{14,6}=125\left(g\right)\)
Chúc bạn học tốt
Bạn ơi cho mik hỏi, tại sao nH2 lại là o,o5 mol v ? 1,12/22,4 là bằng 0,1 ....vậy tại sao lại ra 0,05 v ?

Gọi KL là R
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6(mol)\\ a,2R+6HCl\to 2RCl_3+3H_2\\ \Rightarrow n_R=0,4(mol)\\ \Rightarrow M_R=\dfrac{10,8}{0,4}=27(g/mol)(Al)\\ b,n_{HCl}=1,2(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,2.36,5}{14,6\%}=300(g)\)
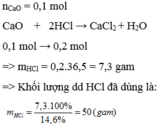
nCaO=0,1(mol)
PTHH: CaO + 2 HCl -> CaCl2 + H2O
nHCl=2.0,1=0,2(mol) => mHCl=0,2.36,5=7,3(g)
=>mddHCl=(7,3.100)/14,6=50(g)
$n_{CaO} = \dfrac{5,6}{56} = 0,1(mol)$
$CaO + 2HCl \to CaCl_2 + H_2O$
$n_{HCl} = 2n_{CaO} = 0,2(mol)$
$m_{dd\ HCl} = \dfrac{0,2.36,5}{14,6\%} = 50(gam)$