Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
n H2 = \(\dfrac{6,72}{22,4}=0,3\) (mol)
=> n Zn = n H2 = 0,3 mol
=> m Zn = 0,3.65= 19,5 (g)

Nzn=0,1mol
a) có pt : Zn + 2Hcl -> ZnCl2 + H2
1 -> 2 -> 1 -> 1 mol
0,1-> 0,2 -> 0,1 -> o,1 mol
b) số Hcl đã dùng khi pứ là :
0,2 . 36,5= 7,3
-> số gam hcl dư là 10,95- 7,3=3,65(g)
c)mZnCl2=0,1 . 136=13,6g

a, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
c, \(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,2}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{2}{15}.56=\dfrac{112}{15}\left(g\right)\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=\dfrac{65}{65}=1\left(mol\right)\\ n_{ZnCl_2}=n_{Zn}=1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=1.136=136\left(g\right)\\ c.n_{H_2}=n_{Zn}=1\left(mol\right)\\ \Rightarrow V_{H_2}=1.22,4=22,4\left(l\right)\)

Câu 3:
c, Từ phần trên, có nH2 = nFe = 0,1 (mol)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)
a) \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: `Fe + 2HCl -> FeCl_2 + H_2`
0,1-->0,2----->0,1------>0,1
`=> m_{FeCl_2} = 0,1.127 = 12,7 (g)`
b) `V_{H_2} = 0,1.22,4 = 2,24 (l)`
c) `n_{Fe_2O_3} = (16)/(160) = 0,1 (mol)`
PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(0,1>\dfrac{0,1}{3}\Rightarrow\) Fe2O3
Theo PT: \(n_{Fe}=\dfrac{2}{3}.n_{H_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)

a,\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4 0,2
b, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
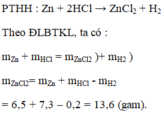
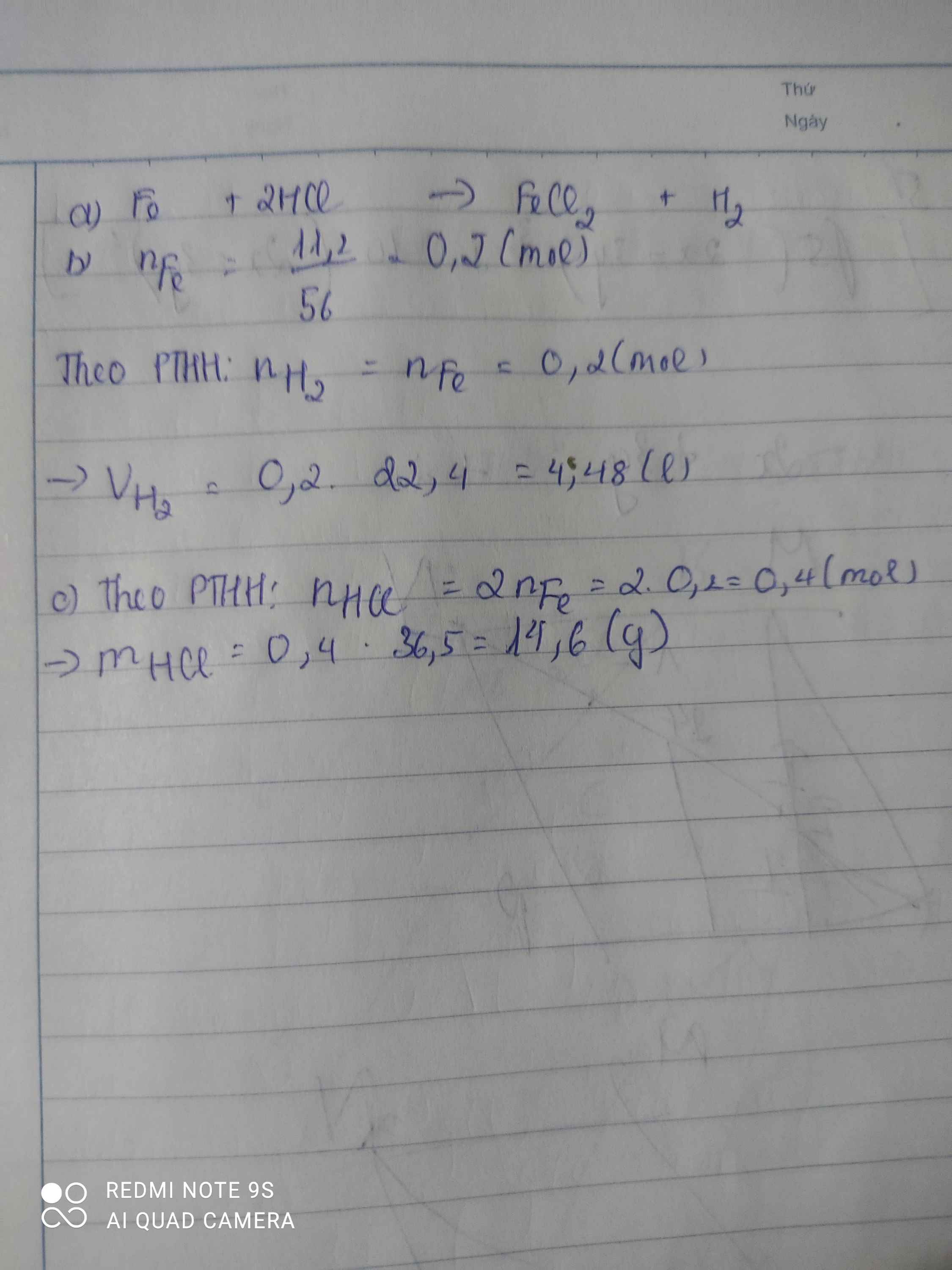
Sửa đề: Thu được ZnCl2
a.b.\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,4 0,2 ( mol )
\(m_{HCl}=n.M=0,4.36,5=14,6g\)
c.\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{32}{160}=0,2mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
\(\dfrac{0,2}{1}\) > \(\dfrac{0,2}{3}\) ( mol )
\(\dfrac{1}{15}\) 0,2 \(\dfrac{2}{15}\) 0,2 ( mol )
\(m_{Fe_2O_3\left(dư\right)}=n.M=\left(0,2-\dfrac{1}{15}\right).160=21,33g\)
\(m_{Fe}=n.M=\dfrac{2}{15}.56=7,46g\)
\(m_{H_2O}=n.M=0,2.18=3,6g\)
Cho Zn vào HCl thu được ZnSO4 là sao :))