Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C1 :
- Hòa tan hh vào dd HCl :
Mg + 2HCl => MgCl2 + H2
Fe + 2HCl => FeCl2 + H2
X : MgCl2 , FeCl2 , HCl dư
Y : Cu
Z : H2
- Dung dịch X + NaOH :
MgCl2 + 2NaOH => Mg(OH)2 + 2NaCl
FeCl2 + 2NaOH => Fe(OH)2 + 2NaCl
Kết tủa T : Mg(OH)2 , Fe(OH)2
- Nung T :
Mg(OH)2 -to-> MgO + H2O
4Fe(OH)2 + O2 -to-> 2Fe2O3 + 4H2O
Chất rắn : MgO , Fe2O3
C2:
Đặt : nCl2 = x (mol) , nO2 = y (mol)
nA = x + y = 0.6 (mol) (1)
mCl2 + mO2 = 48.15 - 19.2 = 28.95 (g)
=> 71x + 32y = 28.95 (2)
(1),(2) :
x = 0.25 , y = 0.35
Đặt : nMg = a (mol) , nAl = b (mol)
Mg => Mg+2 + 2e
Al => Al+3 + 3e
Cl2 + 2e => 2Cl-1
O2 + 4e => 2O2-
BT e :
2a + 3b = 0.25*2 + 0.35*4 = 1.9
mB = 24a + 27b = 19.2
=> a = 0.35
b = 0.4
%Mg = 0.35*24/19.2 * 100% = 43.75%

Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=20\) (1)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{MgCl_2}+2n_{FeCl_2}=2n_{Mg}+2n_{Fe}=2a+2b\)
\(\Rightarrow2a+2b=0,5\cdot2\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,25\end{matrix}\right.\)
+) Trong không khí
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,125\left(mol\right)\\n_{MgO}=n_{Mg}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow m_1=0,125\cdot160+0,25\cdot40=30\left(g\right)\)
+) Trong chân không
Bảo toàn nguyên tố: \(n_{FeO}=n_{Fe}=n_{Mg}=n_{MgO}=0,25\left(mol\right)\)
\(\Rightarrow m_2=0,25\cdot72+0,25\cdot40=28\left(g\right)\)

Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch HNO3, thu được dung dịch X và 4,48 lút khí NO. Cho 3,96 gam kim loại Mg vào X đến khi phản ứng xảy ra hoàn toàn, thu được 224ml khí NO và m gam chất rắn không tan. biết NO là sản phẩm khử duy nhất của N+5. Gía trị cảu m là
A. 6,4 B.12,8 C.9,6 D.4,8

a) \(n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,05<-----------0,05---->0,075
=> \(\%Al=\dfrac{0,05.27}{14,15}.100\%=9,54\%\)
=> \(\%Cu=\dfrac{14,15-0,05.27}{14,15}.100\%=90,46\%\)
b) \(V_{H_2}=0,075.22,4=1,68\left(l\right)\)
c) \(n_{Cu}=\dfrac{14,15-0,05.27}{64}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
2Cu + O2 --to--> 2CuO
0,2-->0,1
=> \(V_{O_2}=\left(0,1+0,0375\right).22,4=3,08\left(l\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ m_{AlCl_3}=6,675\left(mol\right)\\ n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\\ \Rightarrow n_{Al}=n_{AlCl_3}=0,05\left(mol\right)\\ \Rightarrow m_A=0,05.27=1,35\left(g\right);m_{Cu}=14,15-1,35=12,8\left(g\right)\\ \%m_{Cu}=\dfrac{12,8}{14,15}.100\approx90,459\%\\ \Rightarrow\%m_{Al}\approx9,541\%\\ b,n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,075.22,4=1,68\left(l\right)\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ 2Cu+O_2\rightarrow\left(t^o\right)2CuO\\ n_{O_2}=\dfrac{3}{4}.n_{Al}+\dfrac{1}{2}.n_{Cu}=\dfrac{3}{4}.0,05+\dfrac{1}{2}.0,2=0,0875\left(mol\right)\)
\(\Rightarrow V_{O_2\left(đktc\right)}=0,0875.22,4=1,96\left(l\right)\)

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)
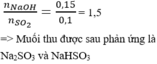
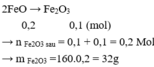

D:MgO và FeO