Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Gọi x, y lần lượt là số mol Al, Fe
Theo đề bài ta có hệ pt
\(\left\{{}\begin{matrix}27x+56y=8,3\\\dfrac{3}{2}x+y=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
a)\(x=\dfrac{\dfrac{0,1.3}{2}+0,1}{0,2}=0,25M\)
b)\(\%m_{Al_2(SO_4)_3}=\dfrac{\dfrac{0,1}{2}.342}{\dfrac{0,1}{2}.342+0,1.152}.100=52,94\%\)
=> %mFeSO4=100-52,94=47,06%
c)\(CM_{Al_2(SO_4)_3}=\dfrac{0,05}{0,2}=0,25M\)
\(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
d) 1> Thu được kết tủa bé nhất
-TH1 : Lượng KOH chỉ phản ứng với FeSO4 tạo kết tủa, không đủ để tạo kết tủa với Al2(SO4)3
\(2KOH+FeSO_4\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
=> \(m_{ddKOH}=\dfrac{0,1.2.56}{15\%}=74,67\left(g\right)\)
TH2: Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 sau đó tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
\(Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6+0,1\right).56}{15\%}=224\left(g\right)\)
2> Thu được kết tủa lớn nhất :
Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 và không tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6\right).56}{15\%}=186,67\left(g\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\left(mol\right)\) \(a\) \(1,5a\) \(0,5a\) \(1,5a\)
\(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\left(mol\right)\) \(b\) \(b\) \(b\) \(b\)
Ta có hpt: \(\left\{{}\begin{matrix}27a+56b=8,3\\1,5a+b=\dfrac{5,6}{22,4}\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\)
\(a.x=\dfrac{1,5a+b}{0,2}=\dfrac{0,15+0,1}{0,2}=1,25\left(M\right)\\ b.\%m_{Al}=\dfrac{27.0,1}{8,3}.100=32,53\left(\%\right)\\ \%m_{Fe}=100-32,53=67,47\left(\%\right)\\ c.C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,5a}{0,2}=0,25\left(M\right)\\ C_{M_{FeSO_4}}=\dfrac{b}{0,2}=0,5\left(M\right)\\ d.\)
\(PTHH:Al_2\left(SO_4\right)_3+6KOH\rightarrow3K_2SO_4+2Al\left(OH\right)_3\)
\(\left(mol\right)\) \(0,05\) \(0,3\) \(0,1\)
\(PTHH:FeSO_4+2KOH\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
\(\left(mol\right)\) \(0,1\) \(0,2\)
\(PTHH:Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
\(\left(mol\right)\) \(0,1\) \(0,1\)
\(d.1.\) Lượng kết tủa bé nhất khi kết tủa \(Al\left(OH\right)_3\) sinh ra tan hết trong dd KOH
Khi đó: \(n_{KOH}=0,6\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,6.100.56}{15}=224\left(g\right)\)
\(d.2.\) Lượng kết tủa lớn nhất khi KOH tác dụng vừa đủ với dd A
Khi đó: \(n_{KOH}=0,5\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,5.56.100}{15}=186,67\left(g\right)\)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\)
Gọi số mol Fe và Al lần lượt là: x và y
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
x x x x
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
y 1,5y 1,5y
Ta có:
\(\left\{{}\begin{matrix}56x+27y=11\\x+1,5y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\%m_{Fe}=\dfrac{0,1.56}{11}.100\%=50,9\%\)
\(\%m_{Al}=100\%-50,9\%=49,1\%\)

Gọi x, y lần lượt là số mol của Fe và Mg ta có:
Fe + 2HCl ---> FeCl2+H2↑
x ----->x
Mg +2HCl--->MgCl2+H2↑
y. ------>y
Ta có hệ phương trình :
56x+24y=8
127x+95y=22,2
Giải ra ta có
x=0,1 y=0,1
%mFe=0,1.56/0,1.(56+24) .100%=70%
=>%mMg=100-70=30%

Bài giải:
2Fe + 6H2SO4 -> Fe2(SO4)3 + 3SO2 + 6H2O
2Al + 6H2SO4 -> Al2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 -> CuSO4 + SO2 + 2H2O
(chú ý là H2SO4 đặc, nóng sẽ khử kim loại tạo muối sunfat kim loại có hóa trị cao nhất)
Lượng 3 muối sunfat = 45,1.2 = 90,2 gam và số mol SO2 = 0,7 mol
Fe2(SO4)3 + 6NaOH -> 2Fe(OH)3 + 3Na2SO4
Al2(SO4)3 + 6NaOH -> 2Al(OH)3 + 3Na2SO4
CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4
Al(OH)3 + NaOH -> NaAlO2 + H2O
Kết tủa lọc được chỉ còn Fe(OH)3 và Cu(OH)2
2Fe(OH)3 -> Fe2O3 + 3H2O
Cu(OH)2 -> CuO + H2O
12.2 = 24 (gam) là tổng lượng 2 oxit Fe2O3 + CuO
Gọi x, y, z lần lượt là số mol của Fe, Al, Cu
Ta có hệ 3 phương trình:
1,5x + 1,5y + z = 0,7
200x + 171y + 160z = 90,2
80x + 80z = 24
Giải hệ cho x = 0,2 ; y = 0,2 ; z = 0,1
Suy ra khối lượng mỗi kim loại trong hỗn hợp ban đầu: mFe = 11,2 g ; mAl = 5,4 g ; mCu = 6,4 g
\\ok//

a, Ta có: 27nAl + 56nFe = 27,8 (1)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%\approx19,42\%\\\%m_{Fe}\approx80,58\%\end{matrix}\right.\)
b, \(n_{H_2SO_4}=n_{H_2}=0,7\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,7}{0,5}=1,4\left(M\right)\)

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
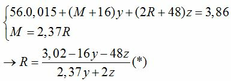
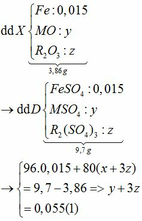
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

Mg +H2SO4--->MgSO4 +H2
x x x x mol
Fe+ H2SO4---> FeSO4+ H2
y y y y mol
theo bài ta có : 24x+ 56y=1,36 và x+y=0,672/22,4
=> x=0,01 mol và y=0,02 mol
=> mMg=0,24 gam mFe=1,12 gam
tớ thấy đề bài khó để là ý b) bạn ạ nếu bạn xem lạ đề bài thì tốt quá![]()

