Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Pư: Mg+2HCl -> MgCl2 +H2
MgO+2HCl-> MgCl2 +H2O
MgCl2+2NaOH-> Mg(OH)2↓+2NaCl
Mg(OH)2-> MgO+H2O
nMgO=14/40=0.35 mol
-> nMg(OH)2=nMgCl2=nMgO=0.35 mol
-> nMgO=nMg=nMgCl2=0.35 mol
gọi x,y lần lượt là số mol của Mg,MgO
->mhh=24x+40y=2 (1)
nMgCl2=x+y=0.35 (2)
giải hệ (1)(2) có x=0.103125
y=0.246875
- khối lượng của bạn nhập sai vì klg hỗn hợp quá nhỏ

2Al + 6HCl -> 2AlCl3 + 3H2 (1)
x_____________2x
Mg + 2HCl -> MgCl2 + H2 (2)
y______________y
AlCl3 + 3NaOH -> Al(OH)3 \(\downarrow\) + 3NaCl (3)
2x_______________2x
MgCl2 + 2NaOH -> Mg(OH)2 \(\downarrow\) + 2NaCl (4)
y__________________y
Vì t/d với NaOH dư nên lượng kết tủa Al(OH)3 tan hết do xảy ra pứ:
NaOH + Al(OH)3 -> NaAlO2 + 2H2O (5)
=> lượng kết tủa thu được chỉ còn Mg(OH)2
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (6)
y___________y
=> Chất rắn đó là MgO => nMgO =\(\dfrac{4}{40}=0,1\left(mol\right)\)
=> y=0,1(mol)
=> mMg = 24. y = 24. 0,1 = 2,4(g)
%mMg = 2,4/24 . 100% =10%
=> %mAl = 100% - 10%= 90%

Bắt đầu xuất hiện kết tủa nghĩa là: NaOH đầu tiên sẽ trung hòa HCl dư trước
NaOH + HCldư → NaCl + H2O
0,2 ←0,2
→ 2V1 = 0,2 → V1 = 0,1
Đến khi kết tủa không thay đổi khối lượng thì khi đó kết tủa bị hòa tan hết.
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
3x ←x → x
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x ←x
→ 0,2 + 4x = 0,6.2 → x = 0,25
=> y = 0,025
=> m = 17,75g

Em tham khảo nhé !
Đặt nAl = a và nFe = b
—> 27a + 56b = 3,28 (1)
nHCl = 0,5 và nNaOH = 0,65
—> nNaCl = 0,5
TH1: Nếu kết tủa vẫn còn Al(OH)3 —> nNaAlO2 = 0,65 – 0,5 = 0,15
Kết tủa gồm Fe(OH)2 (b) và Al(OH)3 (a – 0,15)
Nung ngoài không khí —> Al2O3 (a – 0,15)/2 và Fe2O3 (b/2)
m rắn = 102(a – 0,15)/2 + 160b/2 = 1,6 (2)
(1)(2) —> Vô nghiệm, loại
TH2: Kết tủa chỉ có Fe(OH)2 (b mol)
—> m rắn = 160b/2 = 1,6 (3)
(1)(3) —> a = 0,08 và b = 0,02
—> %Al = 65,85% và %Fe = 34,15%

Mg + 2HCl → MgCl2 + H2 (1)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (2)
nH2 = 2,8/22,4 = 0,125 mol
Theo tỉ lệ phản ứng (1) => nMg = nH2 = 0,125 mol
<=> mMg = 0,125 .24 = 3 gam và mAl2O3 = 8,1 - 3 =5,1 gam
%mMg = \(\dfrac{3}{8,1}\).100% = 37,03% => %mAl2O3 = 100 - 37,03 = 62,97%
b) nAl2O3 = \(\dfrac{5,1}{102}\)= 0,05 mol
=> nHCl pư = 2nMg + 6nAl2O3 = 0,55 mol
mHCl = 0,55.36,5 = 20,075 gam
=> mdung dịch HCl 18% = \(\dfrac{20,075}{18\%}\)= 111,53 gam

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

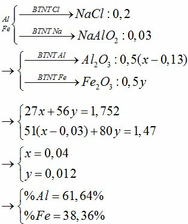
\(PTHH:2Al+6HCl\rightarrow2AlCl3+3H2\)
\(Mg+2HCl\rightarrow MgCl2+H2\)
\(AlCl3+3NaOH\rightarrow Al\left(OH\right)3+3NaCl\)
\(Al\left(OH\right)3+NaOH\rightarrow NaAlO2+2H2O\)
\(MgCl2+2NaOH\rightarrow Mg\left(OH\right)2+2NaCl\)
\(Mg\left(OH\right)2\underrightarrow{to}MgO+H2O\)
Ta có :
\(n_{MgO}=\frac{4}{40}=0,1\left(mol\right)\)
Áp dụng bảo toàn nguyên tố Mg:
\(n_{Mg}=n_{MgO}=0,1\left(mol\right)\)
\(\rightarrow m_{Mg}=0,1.24=2,4g\)
\(\Rightarrow\%m_{Mg}=\frac{2,4}{24}.100\%=10\%\)
\(\%m_{Al}=100\%-10\%=90\%\)
\(m_{Al}=24-2,4=21,6g\rightarrow n_{Al}=\frac{21,6}{27}=0,8\left(mol\right)\)
Theo PTPU:
\(n_{HCl}==2n_{Al}+2n_{Mg}=3.0,8+2.0,1=2,6\left(mol\right)\)
\(\Rightarrow V_{HCl}=\frac{2,6}{2}=1,3l\)
2Al+6HCl--->2AlCl3+3H2(1)
Mg+2HCl----->MgCl2+H2(2)
AlCl3+3NaOH---->Al(OH)3+3NaCl(3)
MgCl2+2NaOH---->Mg(OH)2+2NaCl(4)
Al(OH)3+NaOH-->NaAlO2+2H2O(5)
Mg(OH)2---->MgO+H2O(6)
Do NaOH dư---->AlCl3 bị hòa tan kết tủa
Chất rắn sau pư chỉ còn
n MgO=\(\frac{4}{40}=0,1\left(mol\right)\)
Theo pthh6
n Mg(OH)2=n MgO=0,1(mol)
Theo pthh 4
n MgCl2=n Mg(OH)2=0,1(mol)
Theo pthh3
n Mg=n MgCl2=0,1(mol)
m Mg=0,1.24=2,4(g)
%m Mg=\(\frac{2,4}{24}.100\%=10\%\)
%m Al=100-10=90%
Theo pthh2
n HCl=2n Mg=0,2(mol)
Theo pthh1
n HCl=3n Al=\(\frac{24-2,4}{27}.3=2,4\left(mol\right)\)
\(\sum n_{HCl}=2,4+0,2=2,6\left(mol\right)\)
\(V_{HCl}=\frac{2,6}{2}=1,3\left(l\right)\)