Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Căn cứ vào các tính chất của các halogen ta thấy chỉ có C3H7Cl phản ứng được với dung dịch NaOH đun nóng. Đặt công thức của Y là RCl, phương trình phản ứng :
C3H7Cl + NaOH = C3H7OH + NaCl (1)
mol: x x
AgNO3 + NaCl = AgCl + NaNO3 (2)
mol: x x
Theo (1), (2) và giả thiết ta có :
nC3H7Cl = nNaCl = nAgCl = 1,435/143,5 = 0.01 mol;
mC6H5Cl = 1,91 - 0,01.78,5 = 1,125 gam.
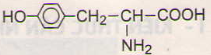 với các chất sau:
với các chất sau:
Đáp án A
Trong X đặt a, b, c lần lượt là số mol của FeCl2 ; Cu ; Fe(NO3)2
Khi cho AgNO3 vào Y thì có NO thoát ra
=>Y có H+ dư và NO3- hết, khi đó nNO = 2c + 0,02 = ¼ nH+ = 0,1
=> c = 0,04 mol
Phần Ag+ phản ứng với Fe2+ = 0,58 – (2a + 0,4)
Bảo toàn e : ne = a + 2b + c = 0,1.3 + 0,58 – (2a + 0,4)
mX = 127a + 64b + 180c = 23,76g
=> a = 0,08 ; b = 0,1 => nAgCl = 2a + 0,4 = 0,56 và nAg = 0,02
=> mtủa = 82,52g