Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi X thành hai nguyên tố R (x mol) và O (y mol).
nSO2 = 8,96/22,4 = 0,4 (mol)
Quá trình khử:
S+6 + 2e ---> S+4
0,8 <-- 0,4
O0 + 2e ----> O-2
y -> 2y
Quá trình oxi hóa:
R0 ----> R+3 + 3e
x --------------> 3x
Áp dụng định luật bảo toàn e:
0,8 + 2y = 3x (1)
Ta lại có:
mO2/mhh . 100% = 22,222%
<=> mO2/46,8 = 0,22222
=> mO2 \(\approx\) 10,4 (g)
=> y = nO2 = 10,4/16 = 0,65 (mol)
Thế y vào (1) ta được x = 0,7 (mol)
mR = 46,8 - 10,4 = 36,4 (g)
=> MR = 36,4/0,7 = 52 (g/mol)
=> R là Cr.

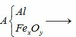
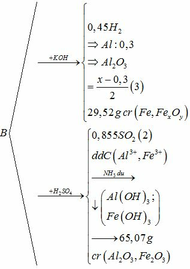
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
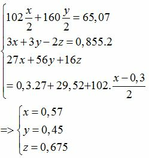
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
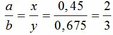
=> Fe2O3

a)
2Al + 6HCl → 2AlCl3 + 3H2↑
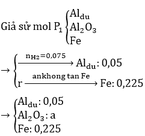
Pt: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Giả sử P2 = kP1
=> a=0.1
=> m = 128,8g
b)
2yAl + 3FexOy → yAl2O3 + 3xFe
0,1 0,225
=> 0,225y = 0,3x => 3y = 4x
=> Fe3O4

Qui đổi hh X về Fe, Cu, Mg, Zn và S
Gọi số mol e cho của hh kim loại là x và số mol của S là y
Ta có m kim loại = 10,42 – 32y

m kết tủa lớn nhất = mM(OH)n + mBaSO4
mM(OH)n = m kim loại + mOH- = 10,42 – 32y + 17x
n BaSO4 = nSO42- =x/2 => mBaSO4 =x/2 .233
=> m kết tủa = 10,42 – 32y + 17x + x/2.233 = 43,96 (2)
Từ (1) và (2) => x = 0,28 và y = 0,12
=> m = 10,42 – 32 . 0,12 + . 96 = 20,02

2yAl +3FexOy -to-> 3xFe + yAl2O3 (1)
phần 1 : Fe +4HNO3 --> Fe(NO3)3 + NO +2H2O (2)
Al2O3 + 6HNO3 --> 2Al(NO3)3 +3H2O (3)
Al +4HNO3 --> Al(NO3)3 +NO +2H2O (4)
P2 : Al2O3 +2NaOH --> 2NaAlO2 +H2O (5)
2Al +2H2O +2NaOH --> 2NaAlO2 +3H2 (6)
vì khi cho phần 2 td vs NaOH dư thấy giải phóng H2 => Al dư sau (1)
nH2=0,015(mol)
nFe(P2)=0,045(mol)
giả sử P1 gấp k lần P2
=> nFe(P1)=0,045k(mol)
theo (5) : nAl(P2)=2/3nH2=0,01(mol)
=>nAl(P1)=0,01k(mol)
nNO=0,165(mol)
theo (2,4) :nNO=(0,045k+0,01k) (mol)
=>0,055k=0,165=> k=3
=>nAl(P1)=0,03(mol)
nFe(p1)=0,135(mol)
\(\Sigma nFe=0,045+0,135=0,18\left(mol\right)\)
\(\Sigma nAl=0,03+0,01=0,04\left(mol\right)\)
mAl2O3=\(14,49-0,135.56-0,03.27=6,12\left(g\right)\)
nAl2O3(P1)=0,06(mol)
=> nAl2O3(P2)=0,02(mol)
\(\Sigma nAl2O3=0,08\left(mol\right)\)
theo (1) : nFe=3x/ynAl2O3
=> 0,18=3x/y.0,08=> x/y=3/4
=>CTHH : Fe3O4
theo (1) :nFe3O4 =1/3nFe=0,06(mol)
=>m=0,04.27+0,06.232=15(g)
bạn Lê Đình Thái ơi bạn giải nhầm tìm m rồi. Cái 0,04 mol đó là mol dư, bạn phải cộng với 0,16 mol phản ứng khi xảy ra phản ứng nhiệt phân nữa.
Kết quả là m=0,2.27+0,06.232=19,32 gam

\(n_{SO_2}=\dfrac{13,644}{22,4}=0,61\left(mol\right)\)
Đặt n Fe = x (mol) =>\(m_{Fe}=56x\)
Vì m Fe = mMg => \(n_{Mg}=\dfrac{56x}{24}=\dfrac{7}{3}x\)
nAl = y(mol)
=> 56x + 56x + 27y = 16,14 (1)
\(Fe\rightarrow Fe^{3+}+3e\) \(S^{+6}+2e\rightarrow S^{+4}\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
Bảo toàn e : 3x + \(\dfrac{7}{3}.2x\) + 3y = 0,61.2 (2)
Từ (1), (2) => x=0,12 ; y=0,1
=> mFe =mMg=0,12.56 = 6,72(g)
m Al = 0,1.27=2,7(g)

Gọi $n_{Fe} = a ; n_{Mg} = b; n_{Al} = c$
Ta có :
$24b = 56a(1)$
$56a + 24b + 27c = 16,14(2)$
$n_{SO_2} = 0,61(mol)$
Bảo toàn electron : $3n_{Fe} + 2n_{Mg} + 3n_{Al} = 2n_{SO_2}$
$\Rightarrow 3a + 2b + 3c = 0,61.2(3)$
Từ (1)(2)(3) suy ra a = 0,12 ; b = 0,28 ; c = 0,1
$m_{Fe} = m_{Mg} = 0,12.56 = 6,72(gam)$
$m_{Al} = 0,1.27 = 2,7(gam)$

35,5 gam chất rắn gồm : $NaHSO_3(a\ mol) , Na_2SO_3(b\ mol)$
Ta có :
\(\left\{{}\begin{matrix}104a+126b=35,5\\a+2b=n_{NaOH}=0,6\end{matrix}\right.\). Suy ra : a = 1,8 ; b = -1,2<0 (loại)
35,5 gam chất rắn gồm : $Na_2SO_3(x\ mol) ; NaOH(y\ mol)$
Ta có :
\(\left\{{}\begin{matrix}126x+40y=35,5\\2x+y=n_{NaOH}=0,6\end{matrix}\right.\). Suy ra : x = 0,25 ; y = 0,1
Suy ra : $n_{SO_2} = x = 0,25(mol) \Rightarrow V = 0,25.22,4 = 5,6(lít)$
Coi oxit gồm kim loại R(hóa trị n) và 0
Gọi $n_R = m(mol) ; n_O = t(mol)$
Muối là $R_2(SO_4)_n : 0,5m(mol)$
Ta có :
$Rm + 16t = 36$
$m_{muối} = 0,5m(2R + 96n) = 80$
Bảo toàn e : $mn = 2t + 0,25.2$
Suy ra : Rm = 32 ; mn = 1 ; t = 0,25
$mn = 1 \Rightarrow m = \dfrac{1}{n}$
$Rm = 32 \Rightarrow R\dfrac{1}{n} = 32 \Rightarrow R = 32n$
Với n = 2 thì $R = 64(Cu)$
Vậy CTHH oxit là CuO
Coi oxit gồm $Fe(x\ mol) ; O(y\ mol)$
Ta có : 56x + 16y = 20,88(1)$
$n_{SO_2} = 0,145(mol)$
Bảo toàn electron : $3x = 2y + 0,145.2(2)$
Từ (1)(2) suy ra x = 0,29 ; y = 0,29$
$n_{Fe} : n_O = 0,29 : 0,29 = 1 : 1$
Do đó, oxit là $FeO$
$n_{Fe_2(SO_4)_3} = \dfrac{1}{2}n_{Fe} = 0,145(mol)$
$m_{Fe_2(SO_4)_3} = 0,145.400 = 58(gam)$