Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

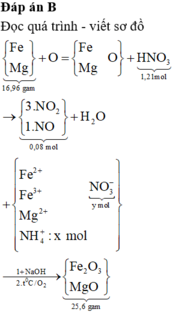
Chọn đáp án B
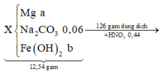

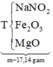
BTE ⇒ 8nNH4NO3 + 0,09 = 2a + c ⇒ 8nNH4NO3 = 2a + c – 0,09
⇒
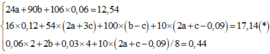
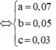
Vậy C%Fe(NO3)3 trong Y 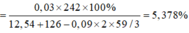

Đáp án B
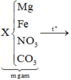
Đọc quá trình - viết sơ đồ
→ quan sát:
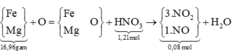
giải hệ Fe, Mg với giả thiết đầu
cuối có nFe = 0,2 mol và nMg = 0,24 mol.
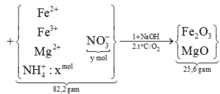
gọi x, y như trên. bảo toàn N có:
x + y + (0,02 + 0,06 × 2) = 1,21 mol.
Khối lượng muối:
mmuối = 82,2 gam = 18x + 62y + 16,96.
Giải hệ được
x = 0,025 mol
và y = 1,045 mol.
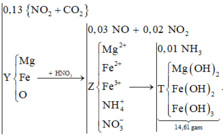
→ giải hệ dung dịch Y có
nFe2+ = 0,06 mol và nFe3+ = 0,14 mol.
Mặt khác, bảo toàn electron lại có:
nHNO3 phản ứng = 10nNH4+ + 10nN2O + 4nNO + 2nO trong oxit
→ nO trong oxit = 0,14 mol
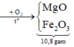
→ mX = 19,2 gam.
Theo đó, mdung dịch Y = 257,96 gam.
→ Yêu cầu C%Fe(NO3)3 trong Y = 0,14 × 242 ÷ 257,96
≈ 13,13%.

Đáp án B
Đặt nN2 = x; nH2 = y ⇒ nA = x + y = 0,05 mol; mA = 28x + 2y = 0,05 × 11,4 × 2
Giải hệ có: x = 0,04 mol; y = 0,01 mol || nO/khí = 2.∑n(NO2, O2) . Bảo toàn nguyên tố Oxi:
nO/H2O = 0,25 × 6 - 0,45 × 2 = 0,6 mol. Bảo toàn nguyên tố Hidro: nNH4+ = 0,02 mol.
nCl–/Z = nHCl = 1,3 mol. Bảo toàn điện tích: nMg2+ = (1,3 - 0,25 × 2 - 0,02)/2 = 0,39 mol.
⇒ m = 0,39 × 24 + 0,25 × 64 + 0,02 × 18 + 1,3 × 35,5 = 71,87(g)
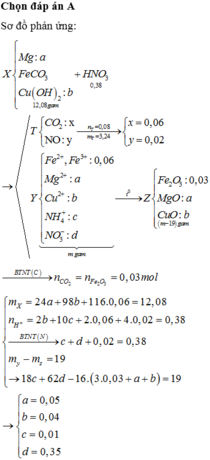
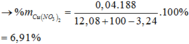

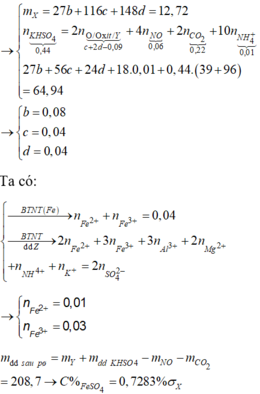


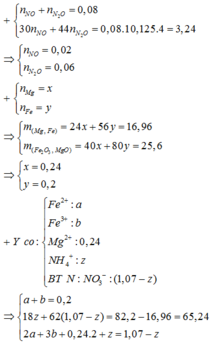




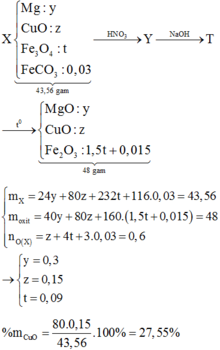
Chọn A