Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Do chứa muối trung hòa nên dung dịch Y chứa Al3+ a mol, Zn2+ b mol, NH4+ c mol và SO42- 0,585 mol.


Chọn đáp án A.
Có khí H 2 thoát ra => Chứng tỏ N O 3 - phản ứng hết.
Dung dịch X chứa: Al3+ (a mol), Zn2+ (b mol), N H 4 + (c mol), S O 4 2 -
⇒ → B T N T 3 a + 2 b + c = 2 . 0 , 585 m m u o i = 27 a + 65 b + 18 c + 96 . 0 , 585 = 79 , 65 g n N a O H = 4 a + 4 b + c = 76 , 4 40 = 1 , 91 m o l
Đặt số mol của CO2, N2 và H2 lần lượt là x, y, z
⇒ x + y + z = 4 , 032 22 , 4 = 0 , 18 m o l
→ B T N T n A l N O 3 3 = 2 y - 0 , 06 3 m o l
![]()
![]()
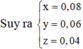
⇒ % m Z n = 39 , 2 %

Đáp án C
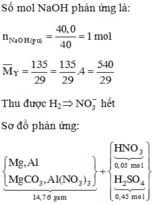
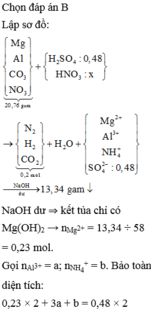
Quan sát sơ đồ quá trình
quy đổi + xử lí:
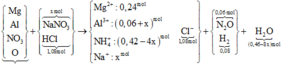
► NaOH vừa đủ xử lí "kép"
dung dịch sau phản ứng:
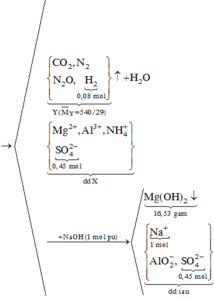
♦1: đọc ra chất rắn cuối cùng
là 0,24 mol MgO
→ biết ∑nMg
(vì thế mà chúng ta có xu hướng
quy đổi lại hỗn hợp X như trên sơ đồ).
♦2: Natri đi về đâu?
gọi nNaNO3 = x mol thì với
1,14 mol NaOH nữa là
∑nNa+ = 1,14 + x mol.
đi về NaCl và NaAlO2
Biết nCl = 1,08 mol nên đọc ra
nNaAlO2 = 0,06 + x mol.
Bảo toàn N có ngay và luôn
nNO3 trong X = (0,54 – 5x) mol.
có mỗi một giả thiết mX = 13,52 g
nên cần tìm nO trong X nữa là sẽ giải
và tìm được x.
♦1 Bảo toàn electron mở rộng:
∑nH+ = 10nN2O + 10nNH4+ + 2nH2 + 2nO trong X
♦2: bảo toàn H tìm nH2O rồi bảo toàn O
(ghép cụm NO3) => nO trong X
→ theo cả 2 cách đều cho biết
nO trong X = 20x – 1,94 mol.
Như phân tích trên:
giải mX = mMg + mAl + mO + mNO3
= 13,52 gam có x = 0,1 mol.
Từ đó đọc ra nO trong X = 0,06 mol
→ nAl2O3 = 0,02 mol; mà ∑nAl = 0,16 mol
→ nAl = 0,12 mol
→ Yêu cầu %mAl trong X ≈ 23,96 %.
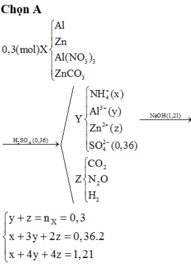
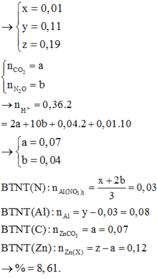
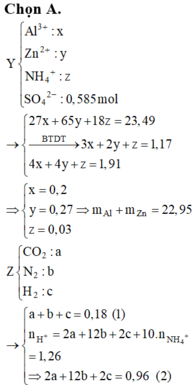
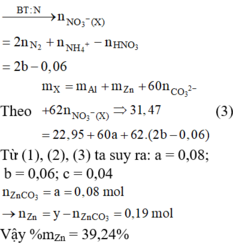
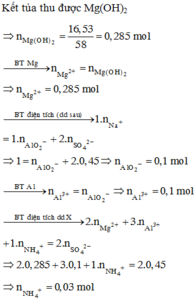
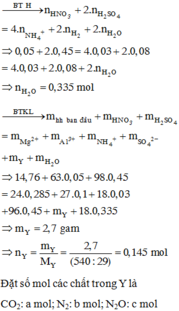

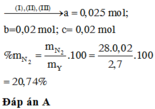
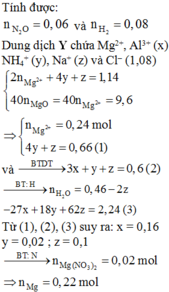
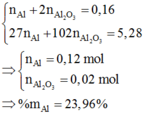


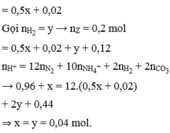
Đáp án A
y + z = n X = 0 , 3 x + 3 y + 2 z = 0 , 36 . 2 x + 4 y + 4 z = 1 , 21 → x = 0 , 01 y = 0 , 11 z = 0 , 19
M C O 2 = M N 2 O = 44 → n C O 2 + n N 2 O = 0 , 11 n H 2 = 0 , 04
n C O 2 = a n N 2 O = b → n H + = 0 , 36 . 2 = 2 a + 10 b + 0 , 04 . 2 + 0 , 01 . 10
→ a = 0 , 07 b = 0 , 04
BTNT(N): n A l ( N O 3 ) 3 = x + 2 b 3 = 0 , 03
BTNT(Al): n A l = y - 0 , 03 = 0 , 08
BTNT(C): n Z n C O 3 = a = 0 , 07
BTNT(Zn): n Z n ( X ) = z - a = 0 , 12
=> %=8,61