Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%

Đáp án C
Qui hỗn hợp về dạng:
Fe và O => mFe + mO = 12g (1)
nNO = 2,24: 22,4 = 0,1 mol
Bảo toàn e: 3nFe = 2nO + 3nNO => 3nFe – 2nO = 0,3 mol (2)
Từ (1,2) => nFe = 0,18 ; nO = 0,12 mol
=> nHNO3 = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64 mol
=> CM (HNO3) = 0,64: 0,2 = 3,2 M
m = mFe = 0,18.56 = 10,08g

C
Quy đổi 15,12 gam X thành : Fe ( x mol ) ; FeO ( y mol ) v à Fe2O3
Hoà tan vào dd HCl ta có pt : x + y = 16,51/127 = 0,13 mol.
Cho X vào HNO3 dư :
Fe ® Fe3+ + 3e N+5 + 3e ® NO
x 3x 0,21 ¬ 0,07
FeO ® Fe3+ + 1e
y y
® Bảo toàn electron: 3x + y = 0,21
Giải hệ ® x = 0,04 mol v à y = 0,09 mol ® % mFe = 0,04.56/15,12 . 100% = 14,81
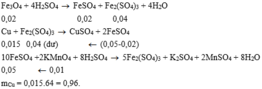
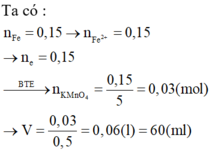


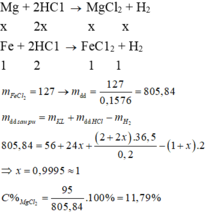
Đáp án A
Các phản ứng: