Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi n lá hóa trị của M
Gọi $n_{Fe} = a(mol) ; n_M = b(mol)$
$\Rightarrow 56a + Mb = 10,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$2M + 2nHCl \to 2MCl_n + nH_2$
Theo PTHH :
$n_{H_2} = a + 0,5bn = \dfrac{6,72}{22,4} = 0,3(2)$
Bảo toàn nguyên tố với Fe,M
$n_{Fe_2O_3} = 0,5a(mol)$
$n_{M_2O_n} = 0,5b(mol)$
Ta có :
0,5a.160 + 0,5b(2M + 16n) = 16(3)
Từ (1)(2)(3) suy ra a = 0,1 ; Mb = 4,8 ; bn = 0,4 => b = 0,4/n
Suy ra :
$M = Mb : b = 4,8 : 0,4/n = 12n$
Với n = 2 thì M = 24(Magie)
$n_{FeCl_2} = a = 0,1(mol)$
$n_{MgCl_2} = n_{Mg} = 0,4 : n = 0,4 : 2 = 0,2(mol)$
Vậy :
$m_{FeCl_2} = 0,1.127 = 12,7(gam)$
$m_{MgCl_2} = 0,2.95 = 19(gam)$

Câu 1
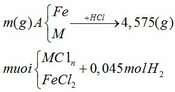
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
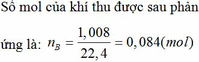
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
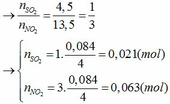
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
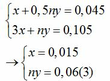
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

\(n_{CuO}=n_{Cu}=\dfrac{4}{80}=0,05mol\\ n_{H_2}=0,4mol\\ n_{Al}=a;n_{Zn}=b\\ 27a+65b=15,1-0,05\cdot64\\ BTe^-:3a+2b=2\cdot0,4\\ a=0,2;b=0,1\\ m_{ddHCl}=\dfrac{\left(0,6+0,2\right)\cdot36,5}{0,2}=146g\)

\(n_{H_2}=\dfrac{4,928}{22,4}=0,22mol\)
\(n_{CuSO_4}=0,66.0,5=0,33mol\)
- Gọi số mol trong phần I là :Fe(x mol), Al(y mol), Ag(z Mol)
- Sỗ mol mỗi kim loại trong phần II: Fe(tx mol), Al(ty mol), Ag(tz Mol)
56(x+tx)+27(y+ty)+108(z+tz)=24,5(*)
- Phần I: Fe+2HCl\(\rightarrow\)FeCl2+H2(1)
2Al+6HCl\(\rightarrow\)2AlCl3+3H2(2)
x+1,5y=0,22(**)
- Phần II: Fe+CuSO4\(\rightarrow\)FeSO4+Cu(3)
2Al+3CuSO4\(\rightarrow\)Al2(SO4)3+3Cu(4)
tx+1,5ty=0,33(***)
152tx+171ty=39,9(****)
- Kết hợp(***) và(****) : tx=0,06, ty=0,18
\(y=3x\)(*****)
- kết hợp (**) và (*****) ta có: x=0,04, y=0,12
\(\rightarrow t=\dfrac{0,06}{0,04}=1,5\)
- Thay x=0,04 ,y=0,12 , t=1,5 vào (*) ta có z=0,04
mI=56x+27y+108z=56.0,04+27.0,12+108.0,04=9,8 gam
số mol Cu=tx+1,5ty=0,33 mol
chất rắn Z gồm 0,33 mol Cu và tz=0,04.1,5=0,06 mol Ag
mZ=0,33.64+0,06.108=27,6 gam

Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g