Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Ta có: \(n_{H_2}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
\(\Rightarrow n_{Al}=0,4mol\) \(\Rightarrow m_{Al}=0,4\cdot27=10,8\left(g\right)\)
\(\Rightarrow\%m_{Al}=\frac{10,8}{12}\cdot100=90\%\)
\(\Rightarrow\%m_{Ag}=10\%\)

Đáp án B
Cho Al và Ag phản ứng với H 2 S O 4 loãng, dư chỉ có Al phản ứng.
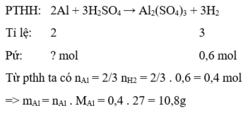
% m A l = 10,8 12 .100 % = 90 % .
% m A g = 100 % - 90 % = 10 %

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
_____0,4<-----------------------------------0,6
=> \(\%Al=\dfrac{0,4.27}{12}.100\%=90\%\)
%Ag = 100% - 90% = 10%

B3: Gọi M là tên kim loại hóa trị III=>oxit của nó là M2O3
mct(H2SO4)=294*20/100=58.8(g)
=>nH2SO4=58.8/98=0.6(mol)
M2O3+3H2SO4=>M2(SO4)3+3H2O
0.2----->0.6(mol)
=>nM2O3=0.6/3=0.2(mol)
=>M2O3=32/0.2=160(g)
=>M=160-48/2=56(g)=>Fe
Vậy công thức của oxit kim loại là Fe2O3.

có nH2= \(\dfrac{6,72}{22,4}\)= 0,3( mol)
nSO2= \(\dfrac{1,12}{22,4}\)= 0,05( mol)
PTPU
2Al+ 3H2SO4\(\rightarrow\) Al2(SO4)3+ 3H2\(\uparrow\)
.0,2...........................................0,3... mol
2Ag+ 2H2SO4 đặc\(\xrightarrow[]{to}\) Ag2SO4+ SO2\(\uparrow\)+ 2H2O
..0,1...............................................0,05............. mol
có: mhh= mAl+ mAg
= 0,2. 27+ 0,1+ 108= 16,5( g)
có: Mhh khí= \(\dfrac{0,3.2+0,05.64}{0,3+0,05}\)= 10, 86( g/ mol)
\(\Rightarrow\) dhh khí/ H2= \(\dfrac{10,86}{2}\)= 5,43

nH2 PT (1) = \(\dfrac{3,36}{22,4}\)= 0,15 (mol)
2Al + 2NaOH + 2H2O ----> 2NaAlO2 + 3H2
0,1 0,15 (mol)
nH2 PT (2), (3) = \(\dfrac{7,84}{22,4}\)= 0,35 (mol)
2Al + 6HCl ----> 2AlCl3 + 3H2
0,1 0,15 (mol)
Mg + 2HCl ----. MgCl2 + H2
0,2 0,2 (mol)
=> mAl = 0,1.27 = 2,7 (g)
=> mMg = 0,2.24 = 4,8 (g)
%Al = \(\dfrac{2,7.100\%}{9}\)= 30%
%Mg = \(\dfrac{4,8.100\%}{9}\)= 53,3%
%Al2O3 = 100 - 30 - 53,3 = 16,7%

Các quá trình khử :
N{+5} + 3e = N{+2} ; N{+5} + e = N{+4} ; 2N{+5} + 8e = 2N{+1} ; S{+6} + 2e = S{+4}
Ʃne (HNO3 nhận) = 3.nNO + nNO2 + 8.nN2O + 2.nSO2 = 1,4 mol
Các quá trình oxy hóa :
Mg - 2e = Mg{+2} ; Al - 3e = Al{+3}
Áp dụng định luật bảo toàn electron, ta có :
2.nMg + 3.nAl = 1,4
Mặt khác, 24.nMg + 27.nAl = 15
=> nMg = 0,4 mol và nAl = 0,2 mol
=> %mMg = 64% và %mAl = 36%