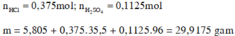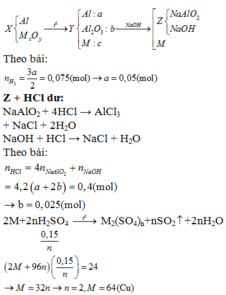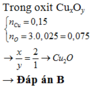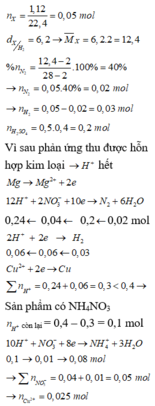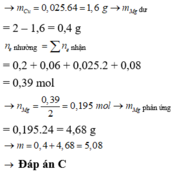Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
Vì phản ứng các axit đồng thời => số mol HCl và H2SO4 phản ứng theo tỷ lệ mol giống như nồng độ mol ban đầu của chúng
=> nHCl : nH2SO4 = 1,5 : 0,45 = 10 : 3 = 10x : 3x
=> 2nH2 = nHCl + 2nH2SO4 => 1,2 mol = 10x + 2.3x
=> x = 0,075 mol
=> Trong muối có : 0,225 mol SO42- và 0,75 mol Cl- ; ion kim loại
( phản ứng hết axit)
=> mmuối = 11,61 + 0,225.96 + 0,75.35,5 = 59,835g

Đáp án A
Đặt nFe = a và nAl = b.
+ Phương trình theo khối lượng hỗn hợp: 56a + 27b = 9,65 (1)
+ Phương trình bảo toàn e là: 2a + 3b = 2nH2 = 0,65 (2)
+ Giải hệ (1) và (2) ⇒ nAl = b = 0,15 mol
⇒ %mAl = 0,15×27/9,65 × 100 ≈ 41,97%

Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g

Đáp án B
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam