Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dễ thấy :
Với X , từ I2 lên I3 tăng đột ngột , vậy ion \(X^{2+}\) có cấu hình của một khí hiếm nên :
\(X:\left[Ar\right]4s^2\left(Ca\right)\)
Với Y , từ I4 lên I5 tăng đột ngột , vậy ion \(I^{4+}\)có cấu hình của một khí hiếm nên :
\(Y:\left[He\right]2s^22p^2\left(C\right)\)
Vậy ...
P/s : bài này mk có lm rồi :D

Ta có bảng sau khi điền
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương |
Sản phẩm ở cực âm |
|
Khí oxi |
H2O pha thêm H2SO4 |
Khí oxi |
Khí hiđro |
|
Khí clo |
NaCl (có màng ngăn) |
Khí clo |
Khí hiđro |
Phương trình điện phân :
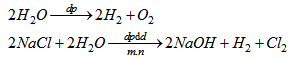

\(\Delta_rH^0_{298}=-542,83-167,16-\left(-795,0\right)=85,01\left(kJ\right)\)
\(\Delta_fH^0_{298}=-542,83-2.167,16-\left(-795,0\right)\) \(=-82,15\left(kJ\right)\)

| Tên hoá chất | Công thức hoá học | Công thức cấu tạo | Loại liên kết |
| Hiđro | \(H_2\) | \(H-H\) | Cộng hoá trị không cực |
| Oxi | \(O_2\) | \(O=O\) | Cộng hoá trị không cực |
| Ozon | \(O_3\) | \(O=O\rightarrow O\) | Cộng hoá trị không cực |
| Nitơ | \(N_2\) | \(N\equiv N\) | Cộng hoá trị không cực |
| Cacbon monoxit | \(CO\) | C O | Cộng hoá trị có cực |
| Cacbon đioxit | \(CO_2\) | \(O=C=O\) | Cộng hoá trị không cực |
| Nước | \(H_2O\) | \(H-O-H\) | Cộng hoá trị có cực |
| Liti florua | \(LiF\) | \(Li^+\cdot\cdot\cdot\cdot\cdot F^-\) | Liên kết ion |
| Flo | \(F_2\) | \(F-F\) | Cộng hoá trị không cực |
| Clo monoflorua | \(ClF\) | \(Cl-F\) | Cộng hoá trị có cực |
| Clo | \(Cl_2\) | \(Cl-Cl\) | Cộng hoá trị không cực |
| Lưu huỳnh đioxit | \(SO_2\) | \(O=S\rightarrow O\) | Cộng hoá trị có cực |
| Hiđro peroxit | \(H_2O_2\) | \(H-O-O-H\) | Cộng hoá trị có cực |
| Lưu huỳnh monoxit | \(SO\) | \(S=O\) | Cộng hoá trị có cực |

Vì các quỹ đạo electron là các hình elip nên phân lớp s của lớp thứ 4 có nhiều năng lượng hơn phân lớp d ở lớp thứ 3. Vì vậy cấu hình của nguyên tử nguyên tố Ca là : 1s2 2s2 2p6 3s2 3p6 4s2

1.\(Al:1s^22s^22p^63s^23p^1\)
Al có 13e → Số hiệu nguyên tử Z = Số e = 13 → Al nằm ở ô thứ 13
có 3 lớp e → ở chu kì 3
e cuối cùng điền vào phân lớp p → thuộc nhóm A
có 3e lớp ngoài cùng → thuộc nhóm IIIA
→ Al là kim loại, khi tham gia hình thành liên kết có xu hướng nhường 3e để đạt đến cấu hình bền của khí hiếm → thể hiện tính khử
\(S:1s^22s^22p^63s^23p^4\)
S có 16e → Số hiệu nguyên tử Z = Số e = 16 → S nằm ở ô thứ 16
có 3 lớp e → ở chu kì 3
e cuối cùng điền vào phân lớp p → thuộc nhóm A
có 6e lớp ngoài cùng → thuộc nhóm VIA
→ S là phi kim, khi tham gia hình thành liên kết có xu hướng nhận 2e để đạt đến cấu hình bền của khí hiếm → thể hiện tính oxi hóa
2.
a) Cl, Br, I thuộc cùng một nhóm, theo chiều tăng của điện tích hạt nhân tính phi kim giảm dần
→ Tính phi kim: Cl > Br > I
b) C, N thuộc cùng một chu kì, theo chiều tăng của điện tích hạt nhân tính axit của các axit tương ứng mạnh dần
→ Tính axit: H2CO3 < HNO3
c) Na, Mg thuộc cùng một chu kì, theo chiều tăng của điện tích hạt nhân, tính bazo của các hidroxit yếu dần
→ Tính bazo: NaOH > Mg(OH)2
Be, Mg thuộc cùng một nhóm, theo chiều tăng của điện tích hạt nhân, tính bazo của các hidroxit mạnh dần
→ Tính bazo: Be(OH)2 < Mg(OH)2
→Tính bazo: NaOH > Mg(OH)2>Be(OH)2

Biến thiên enthalpy chuẩn của phản ứng trên là:
\(\Delta_rH^0_{298}=\) \(2.\Delta_fH^0_{298}\left(CO_2\right)+3.\Delta_fH^0_{298}\left(H_2O\right)-\Delta_fH^0_{298}\left(C_2H_6\right)-\Delta_fH^0_{298}\left(O_2\right)\)
\(=2.\left(-393,50\right)+3\left(-285,84\right)-\left(-84,70\right)=-1559,82\left(kJ\right)\)
ΔfH298=ΣΔ fH298(sp) - ΣΔfH298 (cd) = 2.(-393,5) + 3.(-285,84) - (-84,7) = -1559,82 kJ.
A với d); B với c); C với b); D với a).