Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Có n(NaOH) = 0,15 mol; n(H2) = 0,08 mol.
Dd X gồm Na+; ZnO2-, OH‑.
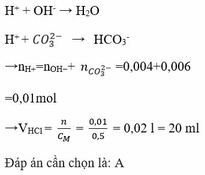
OH- + H+ → H2O
ZnO2- + 2H+ → Zn(OH)2 ↓
Zn(OH)2 + 2H+ → Zn2+ + H2O.
Dùng hết 0,08 mol HCl thì bắt đầu có kết tủa → n(OH-) = 0,08 mol.
Khi cho 0,32 mol HCl hay 0,48 mol HCl vào dd X đều thu được a gam kết tủa.
Có:
n(H+ trước) = 2.n↓ + n(OH-) → n↓ = (0,32 – 0,08) : 2 = 0,12 mol.
n(H+ sau) = 4.n(ZnO2-) – 2n↓ + n(OH-) → n(ZnO2-) = 0,16 mol.
BTĐT trong dd X → n(Na+) = 0,4 mol.
BTNT (H): n(NaOH) + 2n(H2O) = 2.n(H2) + n(OH-)
→ n(H2O) = (2.0,08 + 0,08) : 2 = 0,045 mol.
BTKL: m(hh) + m(NaOH) + m(H2O) = m(H2) + m(Na+) + m(ZnO2-) + m(OH-)
→ m = (0,08.2 + 23.0,4 + 0,16.97 + 0,08.17) – (0,15.40 + 0,045.18) = 19,43 gam.

Đáp án A
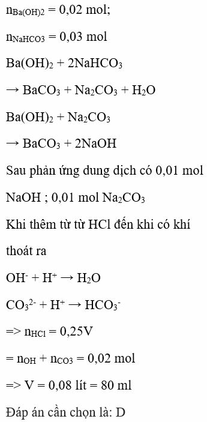
Có nCO32- = nHCO3- = 0,03 mol > nBa2+ = 0,02 mol (có 0,02 mol BaCO3)
⇒ dung dịch X có 0,01 mol CO32-
Và nOH- dư = 0,04 – 0,03 = 0,01 mol,
Để vừa bắt đầu xuất hiện bọt khí thì
nH+ = nOH- + n CO32- = 0,01 + 0,01 =0,02 =0,25V
V =80 ml

Đáp án B
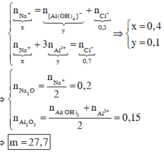
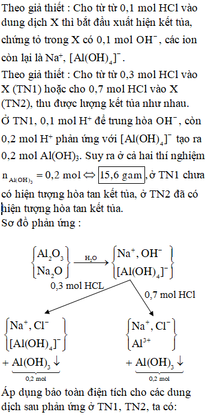
Cho từ từ 0,1 mol HCl vào dung dịch X thì bắt đầu xuất hiện kết tủa, chứng tỏ trong X có 0,1 mol OH - , các ion còn lại là Na+, Al OH 4 - .
Cho từ từ 0,3 mol HCl vào X (TN1) hoặc cho 0,7 mol HCl vào X (TN2), thu được lượng kết tủa như nhau. Ở TN1, 0,1 mol H+ để trung hòa OH - , còn 0,2 mol H+ phản ứng với Al OH 4 - tạo ra 0,2 mol Al(OH)3. Suy ra ở cả hai thí nghiệm
![]()
ở TN1 chưa có hiện tượng hòa tan kết tủa, ở TN2 đã có hiện tượng hòa tan kết tủa.
Sơ đồ phản ứng :
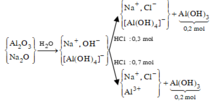
Áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng ở TN1, TN2, ta có :
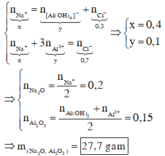
Đáp án cần chọn là: B