Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo đề bài ta có : 2Z + N = 40
N ≥ Z . Vì vậy ta có : 3Z ≥ 40, do đó Z ≤ 40/3 = 13,3 (1)
Măt khác : N/Z ≤ 1,5 → N ≤ 1,5Z
Từ đó ta có : 2Z + N ≤ 2Z + 1,5Z; 40 ≤ 3,5Z
→ Z ≥ 40/3,5 = 11,4 (2)
Tổ hợp (1) và (2) ta có : 11,4 ≤ Z ≤ 13,3 mà z nguyên. Vậy Z= 12 và Z = 13.
Nếu Z = 12 thì N = 16 và A = 28 (trái với đề bài A < 28)
Vậy Z = 13. Đó là nguyên tố nhôm (Al).
Vị trí của nhôm trong bảng tuần hoàn :
+ Ô số 13 ;
+ Chu kì 3 ;
+ Nhóm IIIA.

Đáp án A.
Ta xét hai trường hợp sau:
- Nếu X và Y thuộc chu kì nhỏ thì ta có
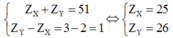
(loại do nhóm IIA và IIIA)
Nếu X và Y thuộc chu kì lớn thì ta có
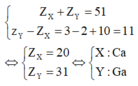
Nhận xét các đáp án:
A đúng: Ca không khử được ion Cu2+ trong dung dịch vì khi cho Ca vào dung dịch chứa Cu2+ thì Ca phản ứng với H2O có trong dung dịch trước:
![]()
Sau đó Cu2+ sẽ phản ứng với OH-:
![]()
B sai: Ở nhiệt độ thường Ca khử được H2O:
![]()
C sai: Hợp chất của Ca với oxi là CaO
D sai: Trong nguyên tử Ca có 20 proton

Chọn B
![]()
X và Y thuộc cùng một chu kì và hai nhóm liên tiếp (nhóm IIA và IIIA) nên ta có các trường hợp sau


Ở nhiệt độ thường X khử được nước, không khử được ion C u 2 + trong dung dịch (do sẽ phản ứng với nước trước), hợp chất với oxi có dạng CaO, trong X có 20 proton.

Zx+zy=51
Hai nhóm liên kết nhau ở chu kỳ 4
=> TH1: zy-zx=1
=>TH2: zy-zx=11

Đáp án:A
Nguyên tố thuộc nhóm IIIA, chu kì 3 có cấu hình e là 1s22s22p63s23p1 → Z = 13 → Al
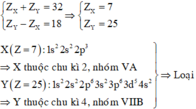

Đáp án B
Hướng dẫn Theo đầu bài hai nguyên tố kế tiếp nhau nên cách nhau một điện tích dương. Giả sử ZX, ZY là số proton của X và Y
Cấu hình electron của X 1s22s22p63s2 ,X ở chu kì 3 nhóm IIA
Cấu hình electron của Y 1s22s22p63s23p1 ,Y ở chu kì 3 nhóm IIIA