Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Vì Na dư nên nó sẽ phản ứng với cả H2O nữa
Coi lượng axit phản ứng là 100 g dd H2SO4 x % => mH2SO4 =x g
H2SO4 --> 2x/98 g H2
Na + H2O --> NaOH + 1/2H2
100-x (100-x)/18
=> 2x/98 + (100-x)/18 = 5 => x=15,8 => C% H2SO4 là 15,8 %
Mg và Na cũng tạo khí vs H2SO4 mà sao chỉ tính mỗi Na dư tạo khí vs H2O vậy.



PTKsắt(III)clorua= 56 + 35,5 . 3= 162,5đvC
PTKamonisunfat= 14.2 + 1.8 + 32 + 16.4 =132đvC
Vật thể tự nhiên: quả chanh,quặng apatit
Vật thể nhân tạo: cốc, que diêm, bóng đèn điện
Chất: nước, axit xitric, thủy tinh, chất dẻo, lưu huỳnh, canxiphotphat, thủy tinh, đồng,vonfram

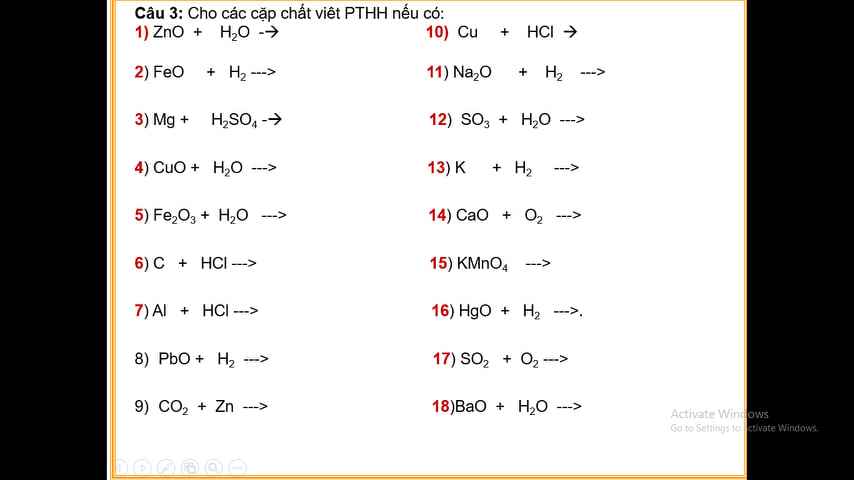
Câu 3 :
1) ZnO + H2O \(\rightarrow\)
2) FeO + H2 → Fe + H2O
3) Mg + H2SO4 → MgSO4 + H2
4) CuO + H2O →
5) Fe2O3 + 3H2O \(\rightarrow\) 2Fe(OH)3
6) C + HCl \(\rightarrow\)
7) 2Al + 6HCl → 2AlCl3 + 3H2
8) PbO + H2 → Pb + H2O
9) CO2 + Zn →
10) Cu + HCl →
11) Na2O + H2 \(\rightarrow\)
12) SO3 + H2O → H2SO4
13) 2K + H2 → 2KH
14) CaO + O2 →
15 ) 2KMnO4 \(\rightarrow\) K2MnO4 + MnO2 + O2
16) HgO + H2 → Hg + H2O
17) 2SO2 + O2 → 2SO3
18) BaO + H2O → Ba(OH)2
Chúc bạn học tốt
Câu 2 : Công thức hóa học :
Mg (II) và O (II)
⇒ CTHH : MgO : magie oxit
H (I) và O (II)
⇒ CTHH : H2O : nước
C (II) và O (II)
⇒ CTHH : CO2 : khí cacbonic
Chúc bạn học tốt

2Al+3H2SO4->Al2(SO4)3+3H2
0,2-----0,3-------0,1------------0,3
n Al=\(\dfrac{5,4}{27}\)=0,2 mol
n H2SO4= \(\dfrac{30}{98}\)=0,306 mol
=>H2SO4 còn dư
=>VH2=0,3.22,4=6,72l
=>m Al2(SO4)3=0,1.342=34,2g
=>m H2SO4 dư=0,006.98=0,588g
\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{m_{H_2SO_4}}{M_{H_2SO_4}}=\dfrac{30}{98}=\dfrac{15}{49}mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2 3 1 3 ( mol )
0,2 15/49 ( mol )
Ta có: \(\dfrac{0,2}{2}< \dfrac{15}{49}:3\)
=> Chất còn dư là \(H_2SO_4\)
\(V_{H_2}=n_{H_2}.22,4=\left(\dfrac{0,2.3}{2}\right).22,4=6,72l\)
\(m_{Al_2\left(SO_4\right)_3}=n_{Al_2\left(SO_4\right)_3}.M_{Al_2\left(SO_4\right)_3}=\left(\dfrac{0,2.1}{2}\right).342=34,2g\)
\(m_{H_2SO_4\left(du\right)}=n_{H_2SO_4\left(du\right)}.M_{H_2SO_4}=\left(\dfrac{15}{49}-\dfrac{0,2.3}{2}\right).98=0,6g\)









 Giải giúp mk đề thi này ik~~tks mb~~^^
Giải giúp mk đề thi này ik~~tks mb~~^^