


Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




\(n_{khi}=n_{H2}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
Gọi số mol Mg, Fe, Cu là a, b, c
Ta có \(24a+56b+64c=28\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H2}=n_{Mg}+n_{Fe}=a+b=0,5\)
Cu không phản ứng
\(\rightarrow64c=9,6\)
\(\rightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\\c=0,15\end{matrix}\right.\)
Cho tác dụng với NaOH
\(HCl+NaOH\rightarrow NaCl+H_2O\)
\(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
0,3 _______________0,3_______________
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
0,2 ________________0,2_______________
\(Mg\left(OH\right)_2\rightarrow MgO+H_2O\)
0,3___________0,3_______
\(Fe\left(OH\right)_2\rightarrow FeO+H_2O\)
0,2__________0,2_______
\(\rightarrow m=0,3.40+0,2.72=26,4\left(g\right)\)

Đáp án B
nSO2 = 1,7 (mol)
Chất rắn Z là Fe2O3, nFe2O3 = 0,4 (mol)
2Febđ → Fe2O3
0,8 ← 0,4 (mol)
Ta có: mX = 1,7 ×64 – 48=60,8 (gam)
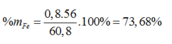

Đầu tiên, chúng ta sẽ viết các phương trình phản ứng cho mỗi bước của quá trình.
Bước 1: Phản ứng giữa hỗn hợp Fe và Al với dung dịch HCl: HCl (dung dịch) + Fe (kim loại) → FeCl2 (dung dịch) + H2 (khí)
2HCl + Fe → FeCl2 + H2
Bước 2: Phản ứng giữi dung dịch X với NaOH tạo kết tủa: X (dung dịch) + 2NaOH → 2NaX (dung dịch) + H2O (lỏng) + Al(OH)3 (kết tủa)
Bước 3: Nung kết tủa Al(OH)3 trong không khí: 2Al(OH)3 → Al2O3 + 3H2O
Bây giờ, chúng ta sẽ tính toán m và a.
Bước 1: Tính lượng H2 thoát ra.
Trước hết, chúng ta cần biết lượng mol của Fe trong hỗn hợp. Công thức của FeCl2 là Fe2+ (một cation sẽ tạo ra 1 mol H2 khi phản ứng với HCl). Vì vậy, số mol của Fe là bằng số mol H2.
Khối lượng mol của H2 là 2 g/mol, vì vậy số mol H2:
n(H2) = 5.6 l / 22.4 l/mol (ở điều kiện tiêu chuẩn) = 0.25 mol
Do đó, số mol Fe = 0.25 mol.
Khối lượng mol của Fe là 55.85 g/mol, vậy khối lượng của Fe là:
m(Fe) = 0.25 mol × 55.85 g/mol = 13.96 g
Bước 2: Tính lượng kết tủa Al(OH)3.
Al(OH)3 có khối lượng mol là 78 g/mol, và theo phương trình phản ứng ta thấy rằng mỗi mol Al(OH)3 tạo ra một mol kết tủa. Vì vậy, số mol Al(OH)3 tạo ra là bằng số mol NaOH đã sử dụng.
Số mol NaOH đã sử dụng được tính theo số mol H2O được tạo ra khi NaOH phản ứng. Một mol NaOH phản ứng với một mol H2O.
n(Al(OH)3) = n(NaOH) = n(H2O) = 0.25 mol
Khối lượng của Al(OH)3:
m(Al(OH)3) = 0.25 mol × 78 g/mol = 19.5 g
Bước 3: Nung kết tủa Al2O3 trong không khí.
Khối lượng của Al2O3 không thay đổi sau quá trình nung. Vì vậy, a = 19.5 g (cùng với m(Al(OH)3)).
Tóm lại:
m = 19.5 g (kết tủa Al(OH)3)a = 19.5 g (sau khi nung thành Al2O3)Các PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+2NaCl\)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\)
\(4Fe\left(OH\right)_2+O_2\xrightarrow[]{t^o}2Fe_2O_3+4H_2O\)
\(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\)
Kết tủa thu được gồm Fe(OH)2 và Al(OH)3
Đặt : \(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(\Rightarrow56a+27b=8,3g\left(1\right)\)
\(Bte:2n_{Fe}+3n_{Al}=2n_{H2}=2a+3b=2.\dfrac{5,6}{22,4}=\left(2\right)\)
Từ(1),(2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1=n_{Fe\left(OH\right)2}\\b=0,1=n_{Al\left(OH\right)3}\end{matrix}\right.\)
\(\Rightarrow m_{kết.tủa}=m_{Fe\left(OH\right)2}+m_{Al\left(OH\right)3}=0,1.90+0,1.78=16,8\left(g\right)\)
\(Bt\left(Al\right):n_{Al}=n_{Al2O3}=0,1\left(mol\right)\)
\(Bt\left(Fe\right):n_{Fe}=n_{Fe2O3}=0,1\left(mol\right)\)
\(\Rightarrow m_{Chất.rắn}=0,1.160+0,1.102=26,2\left(g\right)\)
Chúc bạn học tốt

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M

- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)