Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cảm ơn bạn @anayuiky đã nhắc lỗi sai. Mình sửa lại ý c):
PTHH: \(2KMnO_4\rightarrow^{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Theo phương trình \(n_{KMnO_4}=n_{O_2}.2=0,25.2=0,5mol\)
\(\rightarrow m_{KMnO_4}=0,5.\left(39+55+16.4\right)=79g\)
a. \(n_{H_2}=\frac{V}{22,4}=\frac{11,2}{22,4}=0,5mol\)
\(n_{O_2}=\frac{V}{22,4}=\frac{10,08}{22,4}=0,45mol\)
PTHH: \(2H_2+O_2\rightarrow^{t^o}2H_2O\)
Ban đầu: 0,5 0,45 mol
Trong pứng: 0,5 0,25 0,5 mol
Sau pứng: 0 0,2 0,5 mol
\(\rightarrow M_{O_2\left(dư\right)}=n.M=0,2.32=6,4g\)
b. Theo phương trình \(n_{H_2O}=n_{H_2}=0,5mol\)
\(\rightarrow m_{H_2O}=n.M=0,5.18=9g\)
c. PTHH: \(2KMnO_4\rightarrow^{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,9 0,45 mol
\(\rightarrow n_{KMnO_4}=\frac{2}{1}n_{O_2}=\frac{0,45.2}{1}=0,9mol\)
\(\rightarrow m_{KMnO_4}=n.M=0,9.158=142,2g\)

a) \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(n_{O_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
Xét tỉ lệ: \(\dfrac{0,5}{2}< \dfrac{0,45}{1}\) => H2 hết, O2 dư
PTHH: 2H2 + O2 --to--> 2H2O
0,5-->0,25----->0,5
=> \(m_{O_2\left(dư\right)}=\left(0,45-0,25\right).32=6,4\left(g\right)\)
b) \(m_{H_2O}=0,5.18=9\left(g\right)\)
c)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,5<-----------------------------------0,25
=> \(m_{KMnO_4}=0,5.158=79\left(g\right)\)

a) Do khí oxi thu được hao hụt 10% nên hiệu suất phản ứng là 90%.
Thể tích khí oxi thu được là:
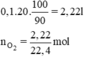
Phương trình hóa học của phản ứng nhiệt phân KMnO4:
2KMnO4 -to→ O2 + K2MnO4 + MnO2.
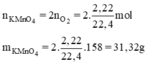
b) Ý b) tách biệt so với ý a), ngoài ra ở ý b) không cho lượng oxi hao hụt là bao nhiêu nên ta lấy hiệu suất phản ứng đạt 100%.
Thể tích khí oxi thu được là: V = 0,1.20 = 2 (lít)


a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b, Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_3O_4}=\dfrac{1}{2}n_{O_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
c, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Có: O2 hao hụt 40% → H% = 100 - 40 = 60%
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,4\left(mol\right)\)
\(\Rightarrow n_{KMnO_4\left(TT\right)}=\dfrac{0,4}{60\%}=\dfrac{2}{3}\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=\dfrac{2}{3}.158\approx105,3\left(g\right)\)

a) \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,2-->0,25
=> VO2 = 0,25.22,4 = 5,6 (l)
=> Vkk = 5,6.5 = 28 (l)
b)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,5<-----------------------------0,25
=> \(m_{KMnO_4}=0,5.158=79\left(g\right)\)

\(n_{H_2}=\dfrac{V}{24,79}=\dfrac{11,2}{24,79}\approx0,45\left(mol\right)\)
a) \(PTHH:2H_2+O_2\underrightarrow{t^o}2H_2O\)
2 1 2
0,45 0,225 0,45
b) \(m_{O_2}=n.M=0,225.\left(16.2\right)=7,2\left(g\right)\\ V_{O_2}=n.24,79=0,225.24,79=5,57775\left(l\right)\)
c) \(PTHH:2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
2 1 1 1
0,45 0,225 0,225 0,225
\(m_{KMnO_4}=n.M=0,45.\left(39+55+16.4\right)=71,1\left(g\right).\)
a, \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=0,25\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,25.32=8\left(g\right)\)
\(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
c, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,5\left(mol\right)\Rightarrow m_{KMnO_4}=0,5.158=79\left(g\right)\)


\(n_{O_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
a. PTHH: \(2KMnO_4-t^o->K_2MnO_4+MnO_2+O_2\uparrow\left(1\right)\)
Theo PT (1) ta có: \(n_{KMnO_4}=\dfrac{0,03.2}{1}=0,06\left(mol\right)\)
=> \(m_{KMnO_4}=0,06.158=9,48\left(g\right)\)
b. PTHH: \(4Al+3O_2-t^o->2Al_2O_3\left(2\right)\)
Theo PT (2) ta có: \(n_{Al}=\dfrac{0,03.4}{3}=0,04\left(mol\right)\)
=> \(m_{Al}=0,04.27=1,08\left(g\right)\)
c. \(n_P=\dfrac{0,93}{31}=0,03\left(mol\right)\)
\(n_{O_2}=0,03\left(mol\right)\)
PTHH: \(4P+5O_2-t^o->2P_2O_5\left(3\right)\)
Theo PT (3) ta có tỉ lệ:
\(\dfrac{0,03}{4}=0,0075>\dfrac{0,03}{5}=0,006\)
=> P dư. \(O_2\) hết => tính theo \(n_{O_2}\)
Các chất sau phản ứng là: P (dư) và \(P_2O_5\)
Theo PT (3) ta có: \(n_{P\left(pư\right)}=\dfrac{0,03.4}{5}=0,024\left(mol\right)\)
=> \(n_{P\left(dư\right)}=0,03-0,024=0,006\left(mol\right)\)
=> \(m_{P\left(dư\right)}=0,006.31=0,186\left(g\right)\)
Theo PT (3): \(n_{P_2O_5}=\dfrac{0,03.2}{5}=0,012\left(mol\right)\)
=> \(m_{P_2O_5}=0,012.142=1,704\left(g\right)\)