Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.

Quy luật của sự biến đổi tính chất vật lí và độ âm điện của các halogen là:
- Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần từ flo đến iot.
- Màu sắc đậm dần từ flo đến iot.
- Độ âm điện giảm dần từ flo đến iot.

Lực Van der Waals là một loại tương tác giữa các phần tử có tiếp xúc với nhau, được đặt tên của nhà vật lý người Hà Lan Johannes Diderik van der Waals, mô tả một loại tương tác phụ thuộc vào khoảng cách giữa các phần tử, công bố đầu tiên vào năm 1873. Các phần tử tham gia vào lực này thường là phân tử.
Thực chất, lực Van der Waals là lực tĩnh điện, thường xuất hiện giữa các phân tử chất khí, khí hóa lỏng hoặc hóa rắn, và trong hầu hết các chất lỏng và chất rắn hữu cơ.
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
-Tương tác van der Waals làm tăng nhiệt độ sôi và nhiệt độ nóng chảy. ⟹ Khí hiếm có nhiệt độ nóng chảy thấp nhất là He và cao nhất là Xe.

a)
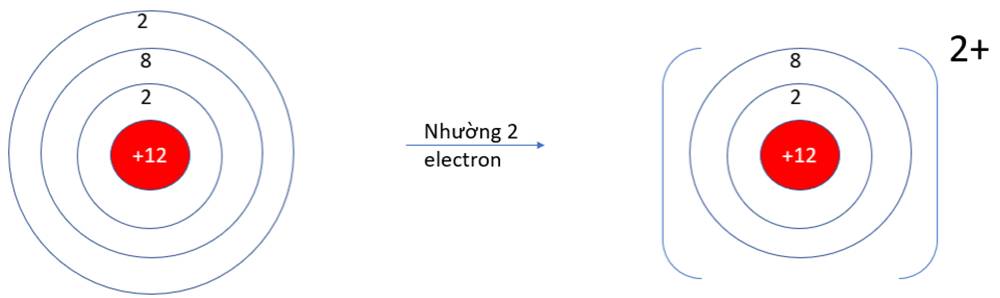
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.

- Trong một chu kì, theo chiều tăng dần điện tích hạt nhân của nguyên tử các nguyên tố:
+ Bán kính: xu hướng giảm dần do điện tích tăng dần nên hạt nhân sẽ hút electron lớp ngoài cùng mạnh hơn.
+ Tính kim loại có xu hướng giảm dần còn tính phi kim có xu hướng tăng dần. Do lực hút của hạt nhân tới electron hóa trị tăng, làm giảm khả năng nhường electron của nguyên tố.
+ Độ âm điện: xu hướng tăng dần do điện tích hạt nhân tăng lên, bán kính nguyên tử giảm dần nên khả năng hút cặp e liên kết càng mạnh.
- Trong một nhóm, theo chiều tăng dần điện tích hạt nhân của nguyên tử các nguyên tố:
+ Bán kính: xu hướng tăng dần do số lớp electron tăng dần.
+ Tính kim loại có xu hướng tăng dần còn tính phi kim có xu hướng giảm dần.. Do lực hút của hạt nhân tới electron hóa trị giảm dần, làm tăng khả năng nhường electron.
+ Độ âm điện: xu hướng giảm dần do theo chiều tăng của điện tích hạt nhân, lực hút của hạt nhân tới cặp electron liên kết giảm.
Ghi chú: Các quy luật về xu hướng biến đổi bán kinh, tính kim loại, tính phi kim, độ âm điện của nguyên tử các nguyên tố trong một chu kì và trong một nhóm chỉ áp dụng cho nguyên tố nhóm A.

- Để so sánh được xu hướng biến đổi một số tính chất của các nguyên tố, ta cần nắm được: Theo chiều tăng của điện tích hạt nhân nguyên tử:
+ Bán kính nguyên tử: giảm dần trong một chu kì, tăng dần trong một nhóm A.
+ Độ âm điện: tăng dần trong một chu kì, giảm dần trong một nhóm A.
+ Tính kim loại: giảm dần trong một chu kì, tăng dần trong một nhóm A.
+ Tính phi kim: tăng dần trong một chu kì, giảm dần trong một nhóm A.
- Giải thích:
+ Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng do lực hút giảm.
+ Độ âm điện phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng.
+ Tính kim loại và phi kim phụ thuộc vào bán kính và lực hút giữa hạt nhân với các electron lớp ngoài cùng.
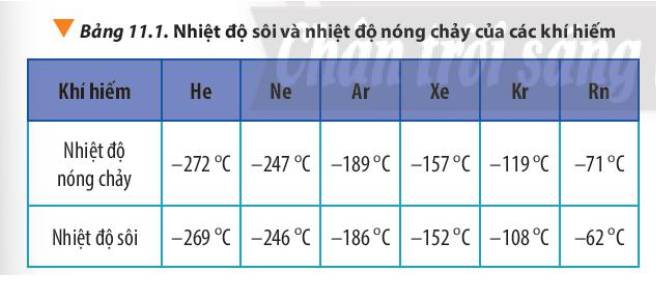
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
Theo chiều tăng dần của điện tích hạt nhân nguyên tử trong nhóm VIIIA, bán kính nguyên tử tăng đồng thời khối lượng nguyên tử tăng ⇒ Tương tác van der Waals tăng ⇒ Nhiệt độ nóng chảy và nhiệt độ sôi tăng.