Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(P1:\)
\(Ag^++Cl^-\rightarrow AgCl\)
\(n_{AgCl}=n_{Cl^-}=\dfrac{11.48}{143.5}=0.08\left(mol\right)\)
\(P2:\)
\(n_{BaCO_3}=0.08\left(mol\right)\Rightarrow n_{HCO_3^-}=0.08\left(mol\right)\)
\(P3:\)
\(OH^-+HCO_3^-\rightarrow CO_3^{2-}+H_2O\)
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\)
\(n_{BaCO_3}=\dfrac{9.85}{197}=0.05\left(mol\right)\Rightarrow n_{Ba^{2+}}=0.05\left(mol\right)\)
Bảo toàn điện tích :
\(n_{Na^+}=0.08+0.08-0.05\cdot2=0.06\left(mol\right)\)
\(m=3\cdot\left(0.08\cdot35.5+0.08\cdot61+0.05\cdot137+0.06\cdot23\right)=47.85\left(g\right)\)

Đáp án C
Gọi số mol mỗi ion NH4+, K+, CO32-, SO42- trong mỗi phần lần lượt là x, y, z , t mol
Phần 1: Ba2++ CO32-→ BaCO3
z z
Ba2++ SO42- → BaSO4
t t
NH4++ OH-→ NH3+ H2O
x x = 0,3 mol
mkết tủa= mBaCO3+ mBaSO4= 197z+233t= 43 suy ra t= 0,1 mol
Phần 2: 2H++ CO32- → CO2+ H2O
z mol z mol= 0,1
Định luật bảo toàn điện tích: x+y=2z+ 2t suy ra y= 0,1 mol
mmuối= (18x+ 39y+60z+96t).2= 49,8 gam

Đáp án A
Gọi công thức TB của hai muối cacbonat là: M ¯ C O 3
M ¯ C O 3 → t 0 M O + C O 2 ( 1 )
Chất rắn Y ( M ¯ C O 3 ; M ¯ O )
n C O 2 ( 1 ) = 3 , 36 22 , 4 = 0 , 15 m o l
Y tác dụng với dung dịch HCl dư
M ¯ C O 3 + 2 H C l → t 0 M ¯ C l 2 + C O 2 + H 2 O ( 2 ) M ¯ O + H C l → t 0 M ¯ C l 2 + H 2 O ( 3 ) C O 2 + B a ( O H ) 2 → B a C O 3 + H 2 O ( 4 ) 2 C O 2 + B a ( O H ) 2 → B a ( H C O 3 ) 2 ( 5 ) B a ( H C O 3 ) 2 → t 0 B a C O 3 + C O 2 + H 2 O ( 6 ) n B a C O 3 ( 4 ) = 9 , 85 197 = 0 , 05 m o l n B a C O 3 ( 6 ) = 9 , 85 197 = 0 , 05 m o l
Theo PT (4,5,6): n C O 2 ( 3 ) = 0 , 15 m o l
Theo PT (1,2):
n M ¯ C O 3 = n C O 2 ( 2 ) + n C O 2 ( 1 ) = 0 , 15 + 0 , 15 = 0 , 3 m o l
Muối khan là: M ¯ C l 2
M ¯ C O 3 → M ¯ C l 2 M ¯ + 60 M ¯ + 71
0,3 mol muối cacbonat pư tạo 0,3 mol muối clorua tăng 3,3(g).
Khối lượng muối cacbonat ban đầu là: 38.15-3,3= 34,85(g)
Giá trị của m = 34,85(g)

Đáp án A
Phần 1:
NH4++ OH- →NH3+ H2O
0,03← 0,03
Fe3++ 3OH-→ Fe(OH)3
0,01 0,01
Phần 2:
Ba2++ SO42- →BaSO4
0,02 0,02
Theo ĐLBT ĐT thì nCl-= 0,02 mol
Tổng khối lượng các muối khan thu được là: (0,03.18+ 0,01.56+ 0,02.96+ 0,02.35,5) = 3,73 gam

Đáp án A
-Phần 1:
Mg2++ 2OH- → Mg(OH)2
0,01 0,01
NH4++ OH- → NH3+ H2O
0,03 0,03
-Phần 2:
Ba2++ SO42- → BaSO4
0,02 0,02
Theo ĐLBT ĐT thì số mol Cl- bằng 0,01 mol
Tổng khối lượng các chất tan trong dung dịch E bằng:
(0,01.24+ 0,03.18+ 0,02.96+ 0,01.35,5).2= 6,11 gam

Đáp án B
Xử lí dữ kiện T: – Phần 2: naxit = 0,2 mol. Giả sử Z là CH3OH.
⇒ axit là HCOOH ⇒ nAg tạo ra do HCOOH = 0,4 mol = ∑nAg ⇒ vô lí!.
||⇒ Z có dạng RCH2OH (R khác H) ⇒ nRCHO = nAg ÷ 2 = 0,2 mol.
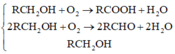
⇒ nH2O = nRCOOH + nRCHO = 0,4 mol. Lại có:
nRCH2OH dư + nRCOOH + nH2O = 2nH2 ⇒ nRCH2OH dư = 0,2 mol.
► Rắn khan gồm 0,2 mol RCH2ONa; 0,2 mol RCOONa và 0,4 mol NaOH.
⇒ R = 29 ⇒ Z là C3H7OH với số mol 0,6 × 3 = 1,8 mol = nKOH.
⇒ KOH dư 0,6 mol ⇒ Mmuối = (210 – 0,6 × 56) ÷ 1,8 = 98 (CH3COOK).
Este X là CH3COOC3H7 ⇒ X là propyl axetat

Đáp án C
Gọi số mol mỗi ion NH4+, Na+, CO32-, SO42- trong mỗi phần lần lượt là x, y, z , t mol
Phần 1: Ba2++ CO32-→ BaCO3
z z
Ba2++ SO42- → BaSO4
t t
NH4++ OH-→ NH3+ H2O
x x = PV/RT= 0,02 mol
mkết tủa = mBaCO3+ mBaSO4 = 197z+233t = 4,3 suy ra t = 0,01 mol
Phần 2: 2H++ CO32- → CO2+ H2O
z mol z mol = 0,01
Định luật bảo toàn điện tích: x+y = 2z+ 2t suy ra y = 0,02 mol
mmuối = (18x+ 23y+60z+96t).2 = 4,76 gam

Đáp án D