Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_S=\frac{0,224}{32}=0,007mol\)
\(n_{Zn}=\frac{0,650}{65}=0,01mol\)
\(n_S\)\(<\)\(n_{Zn}\)
\(\rightarrow\) chất dư là Zn, số mol của pt tính theo S:
Zn + S \(\rightarrow\) ZnS
0,007 0,007 0,007 ( mol )
Sau pư chất thu được trong ống nghiệm là: Zn dư ; ZnS
\(n_{Zn\left(dư\right)}=0,01-0,007=0,003\left(mol\right)\)
\(m_{ZnS}=0,007.97=0,697\left(g\right)\)
\(m_{Zn\left(dư\right)}=0,003.65=0,195\left(g\right)\)

https://hoc24.vn/hoi-dap/question/578153.html
mình đã giải ở đó rồi

n Zn = 0,65/65 = 0,01 mol; n S = 0,224/32 = 0,007 mol
Zn + S → ZnS (1)
Theo (1) sau phản ứng trong ống nghiệm thu được:
n ZnS = 0,007 mol
m ZnS = 0,007x97 = 0,679 (g)
n Zn dư = (0,01 - 0,007) = 0,003 mol
m Zn dư = 65.0,003 = 0,195g

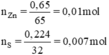
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S  ZnS
ZnS
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

nZn = 0,65 / 65 = 0,01 mol.
nS = 0,224 /32 = 0,007 mol.
Phương trình hóa học của phản ứng
Zn + S →to ZnS
nZn phản ứng = 0,07 mol.
nZnS = 0,07 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
nZn = 0,65 / 65 = 0,01 mol.
nS = 0,224 /32 = 0,007 mol.
Phương trình hóa học của phản ứng
Zn + S →to ZnS
nZn phản ứng = 0,07 mol.
nZnS = 0,07 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

a)
$n_{Zn} = 0,01(mol) ; n_{S} =0,007(mol)$
$Zn + S \xrightarrow{t^o} ZnS$
$n_{Zn} > n_S$ nên Zn dư
$n_{ZnS} = n_{Zn\ pư} = n_S = 0,007(mol)
Sau phản ứng :
$m_{ZnS} = 0,007.97 = 0,679(gam)$
$m_{Zn\ dư} = (0,01 - 0,007).65 = 0,195(gam)$
b)
2Zn + O2 \(\xrightarrow{t^o}\) 2ZnO
0,01.................0,01........(mol)
S + O2 \(\xrightarrow{t^o}\) SO2
0,007................0,007..............(mol)
Sau phản ứng :
$m_{ZnO} = 0,01.81 = 0,81(gam)$
$m_{SO_2} = 0,007.64 = 0,448(gam)$

\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
Do khi hòa tan A vào HCl thu được hỗn hợp khí
=> Trong A chứa H2, H2S
=> Al dư, S hết
PTHH: 2Al + 3S --to--> Al2S3
0,2<--0,3------>0,1
2Al + 6HCl --> 2AlCl3 + 3H2
0,1----------------------->0,15
Al2S3 + 6HCl --> 2AlCl3 + 3H2S
0,1------------------------>0,3
=> \(\overline{M}_X=\dfrac{0,15.2+0,3.34}{0,15+0,3}=\dfrac{70}{3}\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{\dfrac{70}{3}}{2}=\dfrac{35}{3}\)

Đáp án A.
nMg = 0,2 (mol), nS = 0,1 (mol)
Mg + S → MgS
0,2 0,1 0,1 (mol) , Mg dư
mCr = mMgS + mMg = 0,1. (24+32) + 0,1.24 = 8g

