Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 7: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right);n_S=\dfrac{0,32}{32}=0,01\left(mol\right)\)
\(Al\rightarrow Al^{3+}+3e\) \(8H^++SO_4^{2-}+6e\rightarrow S+4H_2O\)
\(4H^++SO_4^{2-}+2e\rightarrow SO_2+2H_2O\)
Bảo toàn e : \(n_{SO_2}.2+n_S.6=n_{Al}.3\)
=> \(n_{SO_2}=\dfrac{0,1.3-0,01.6}{2}=0,12\left(mol\right)\)
=> \(V_{SO_2}=2,688\left(l\right)\)
\(n_{H_2SO_4}=\dfrac{0,01.8+0,12.4}{2}=0,28\left(mol\right)\)
Mình bị nhầm chỗ số mol H2SO4 nha
Sửa lại : \(n_{H^+}=4n_{SO_2}=0,6\left(mol\right)\)
Do H2SO4 ---------> 2H+ + SO42-
=> \(n_{H_2SO_4}=\dfrac{1}{2}n_{H^+}=0,3\left(mol\right)\)

Đáp án B
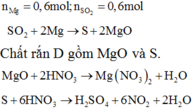
![]()
![]()
Khi cho Ba(OH)2 vào Y thu được kết tủa gồm Mg(OH)2 và BaSO4
![]()

PTHH: Fe + 2HCl --> FeCl2 + H2
FeS + 2HCl --> FeCl2 + H2S
=> \(n_{Fe}+n_{FeS}=n_{H_2}+n_{H_2S}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Và 56.nFe + 88.nFeS = 18,8
=> \(\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_{FeS}=0,15\left(mol\right)\end{matrix}\right.\)
Bảo toàn S: nCaSO3 = 0,15 (mol)
=> m = 0,15.120 = 18 (g)
=> B


Đáp án C
Số mol FeS 2 là: