Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có:
![]()
nên số liên kết của chất béo là 7.
Trong đó có 3 liên kết ở trong chức este
số liên kết để cộng hợp brom là: 4
![]()
Chú ý: Cơ sở lý thuyết khi giải bài toán như trên.
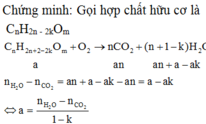
Khi đốt cháy hợp chất hữu cơ X chỉ chứa C;H;O thì ta có:
![]()
(với k là độ bão hòa, tức là tổng số vòng và liến kết pi)

Chọn đáp án B
n co 2 - n H 2 O = 0 . 6 = 6 n cb ⇒
⇒ số liên kết pi trong chất béo: 6 +1 = 7
Số liên kết pi trong mạch cacbon( trừ đi lk pi trong 3 nhóm R-COO):7 − 3 = 4
⇒ n Br 2 = 0 . 3 x 4 = 1 . 2 ⇒ V = 2 . 4 ( L )

Chọn đáp án C
► Chất béo là trieste của glixerol và các axit béo ||→ este 3 chức có 3πC=O.
Giả thiết: đốt 0,01 mol chất béo → 0,57 mol CO2 + 0,51 mol H2O
||→ tương quan: (∑πtrong chất béo – 1)nchất béo = ∑nCO2 – ∑nH2O
||→ ∑πtrong chất béo = 7 = πCO + πC=C ||→ πC=C = 4.
Theo đó, khi dùng 0,3 mol chất béo ⇄ nπC=C = 1,2 mol
||→ nBr phản ứng = 1,2 mol → V = 2,4 lít.

Giải thích:
Br2 chỉ tác dụng với liên kết bội trong gốc axit nên độ không no của gốc axit = 4
=> Độ không no của X = 4 + 3 = 7
=> nX = (nH2O - nCO2) / (1 - 7)
=> nCO2 = 6nX + nH2O
=> V = 22,4(6a + b)
Đáp án D

Chọn đáp án D
1πC=C + 1Br2 mà 1 mol X + 4 mol Br2 ⇒ X có 4πC=C.
Lại có X là chất béo ⇒ X sẵn có 3πC=O ||⇒ ∑πtrong X = 3 + 4 = 7.
♦ đốt a mol X + O2 → t o V lít CO2 + b mol H2O.
tương quan đốt: ∑nCO2 – ∑nH2O = (∑πtrong X – 1)nX
Thay số có ∑nCO2 = b + 6a ⇒ V = 22,4(b + 6a) lít.

Đáp án là D
Vì 1 mol chất béo X phản ứng tối đa 4 mol Br2 nên trong phân tử có 7 liên kết pi ( tính cả 3 liên kết pi trong chức –COO- )
Nên với phần đốt cháy thì:
nCO2 – nH20 = (7-1)nX
? nCO2 = b +6a
? VCO2 = 22,4.(b + 6a) l
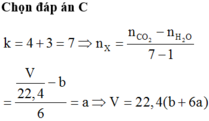
Chọn đáp án B