
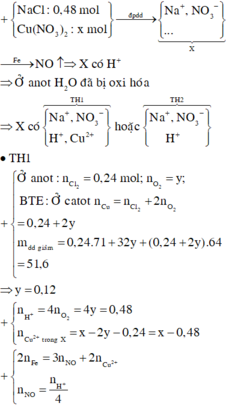
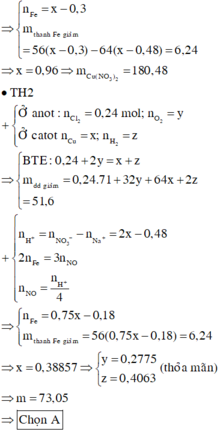
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

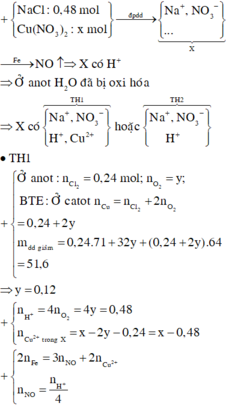
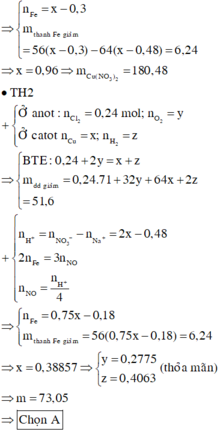

nNaCl = 0,48 mol
Do khi cho Fe vào dung dịch X thì thấy thoát ra khí NO là sản phẩm khử duy nhất nên H2O đã bị điện phân ở anot.
Catot:
Cu2+ +2e → Cu
x…….2x……x
Anot:
Cl- -1e → 0,5Cl2
0,48…0,48…0,24
2H2O - 4e → O2 + 4H+
4y…..y…..4y
n e trao đổi = 2x = 0,48 + 4y (1)
m dung dịch giảm = mCu + mCl2 + mO2 => 64x + 71.0,24 + 32y = 51,6 (2)
Giải (1) và (2) => x = 0,48; y = 0,12
=> nH+ = 0,48 mol
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,18 ← 0,48
Fe + Cu2+ → Fe2+ + Cu
z z z
Khối lượng thanh sắt giảm: (z+0,18).56 – 64z = 6,24 => z = 0,48 mol
=> nCu(NO3)2 ban đầu = x + z = 0,48 + 0,48 = 0,96 mol
=> m = 0,96.188 = 180,48 gam
Đáp án B

Đáp án B
nNaCl = 0,48 mol
Do khi cho Fe vào dung dịch X thì thấy thoát ra khí NO là sản phẩm khử duy nhất nên H2O đã bị điện phân ở anot.
Catot:
Cu2+ +2e → Cu
x…….2x……x
Anot:
Cl- -1e → 0,5Cl2
0,48…0,48…0,24
2H2O - 4e → O2 + 4H+
4y…..y…..4y
n e trao đổi = 2x = 0,48 + 4y (1)
m dung dịch giảm = mCu + mCl2 + mO2 => 64x + 71.0,24 + 32y = 51,6 (2)
Giải (1) và (2) => x = 0,48; y = 0,12
=> nH+ = 0,48 mol
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,18 ← 0,48
Fe + Cu2+ → Fe2+ + Cu
z z z
Khối lượng thanh sắt giảm: (z+0,18).56 – 64z = 6,24 => z = 0,48 mol
=> nCu(NO3)2 ban đầu = x + z = 0,48 + 0,48 = 0,96 mol
=> m = 0,96.188 = 180,48 gam

Chọn A.
Khí thoát ra tại anot gồm Cl2 (0,15 mol)
và O2 (a mol).
![]()
Þ mdd giảm =
64.(0,15 + 2a) + 71.0,15 + 32a = 28,25
Þ a = 0,05.
Dung dịch X gồm NaNO3, HNO3
(4a = 0,2 mol) và Cu(NO3)2 dư (x – 0,25 mol).
Khi cho Fe vào dung dịch X thì:
3Fe + 8HNO3 ® 3Fe(NO3)2 + 2NO + 4H2O ,
![]()
Fe + Cu(NO3)2 ® Fe(NO3)2 + Cu (2) , Dmtăng (2) = (64 – 56).(x – 0,25) = 8x – 2 (g)
Theo đề: 4,2 – (8x – 2) = 3 Þ x = 0,4

Đáp án C
n N a C l = 0,18 mol
Điện phân dung dịch X sau một thơi gian thấy giảm 18,65 gam
Cho Fe vào dung dịch thu được 0,035 mol NO do vậy dung dịch có H+. Do đó Cl- bị điện phân hết trước Cu2+.
Ta có:
![]()
(do Fe dư).
Lượng Fe bị ăn mòn do phản ứng này là chính bằng khối lượng thanh Fe giảm.
Do vậy Cu2+ bị điện phân hết
Ta có:
![]()
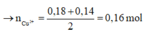
Vậy m H 2 O d p = 18,65 - 0,16.64 - 0,09.71 - 0,035.32 = 0,9 g

Đáp án B
Ta có: ![]()
Điện phân X đến khi dung dịch giảm 24,88 gam thì dừng. Dung dịch thu được 2 chất tan. Cho Mg vào Y thấy thành Mg giảm 3,36 gam chứng tỏ có H+.
Do vậy hai chất tan trong Y là H2SO4 và Na2SO4
![]()
Cu2+ bị điện phân hết và có sinh ra 0,28 mol H+
=> 
Dung dịch bị giảm do Cu2+, Cl- và H2O bị điện phân.
![]()
![]()
Giải được: x=0,01.
Vậy ở anot thu được 0,1 mol Cl2 và 0,075 mol O2.
![]()

Chọn A.
Khi cho Fe tác dụng với Y thì hỗn hợp rắn gồm Cu và Fe dư.
với nFe pư =
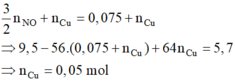
và n H + = 4 n NO = 0 , 2 mol . Dung dịch Y gồm Cu2+ (0,05); H+ (0,2); Na+ (0,5V) và NO3- (2V)
→ BTDT V = 0,2. Dung dịch ban đầu gồm Cu(NO3)2 (0,2 mol) và NaCl (0,1 mol)
Khối lượng dung dịch giảm: m = 64.(0,2 - 0,05) + 71.0,05 + 32.0,05 = 14,75 (g)