Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
Hai chất tan là Na2SO4 (0,05 mol) và Al2(SO4)3 (0,05 mol)
Þ Dung dịch X chứa CuSO4: 0,2 mol và NaCl: 0,1 mol
Tại catot có Cu (0,2 mol) và H2 (a mol) và tại anot có Cl2 (0,05 mol) và O2 (b mol)![]()
và mdd giảm = 0,2.64 + 2a + 0,05.71 + 32b = 20,55
Þ a = 0,1 và b = 0,125. Vậy t = 6h

Chọn D
Gọi số mol của CuSO4 và NaCl lần lượt là x và 3x (mol)
Thứ tự điện phân các chất tại catot và anot
Tại catot:
Cu2+ +2e → Cu↓
2H2O + 2e → 2OH- + H2
Tại anot:
2Cl- → Cl2 + 2e
2H2O → 4H+ + O2↑ + 4e
Vì nCl- = 3nCu2+ và chất tan thu được hòa tan được Al2O3 => Cl- điện phân hết.
2 chất tan thu được là Na2SO4 : x ( mol) ; NaOH: (3x – 2x) = x (mol)
2NaOH + Al2O3 → 2NaAlO2 + H2O
0,06 ← 0,03 (mol)
=> x = nNaOH = 0,06 (mol)
Tại catot: Cu: 0,06 mol; nH2 = a (mol)
Tại anot: Cl2: 0,09 mol; nO2 = b (mol)
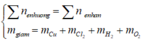
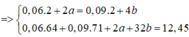
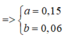
=> ∑ ne = 0,06.2 + 2.0,15 = 0,42 (mol)
Áp dung CT ta có: ne = It/F => t = 0,42.96500/2 = 20265 (s) = 5,63 (giờ)
Gần nhất với 5,6 giờ

Đáp án : B
Điện phân hỗn hợp. CuSO4 x mol , NaCl 3x mol.
- Thứ tự điện phân trong dung dịch :
Cu2+ + 2Cl- à Cu↓ + Cl2 ↑ (1)
(mol) x 2x x x
hết Cu2+ : 2Cl- + 2H2O à 2OH- + H2 ↑ + Cl2 ↑ (2)
(mol) x x 0,5x 0,5x
Dung dịch Y chứa hai chất tan là Na2SO4 và NaOH => Hết ion Cl-
- Tính số mol OH- theo số mol H2:
2Al + 2OH- + 2H2O à 2AlO2- + 3H2 ↑
(mol) x = 0,05 ß---------------------0,075
- Khối lượng dung dịch giảm:
64.0,05 + 71.0,05 + 71.0,5.0,05 + 2.0,5.0,05 = 8,575 < 10,375 gam => H2O bị điện phân
Khối lượng H2O bị điện phân : 10,375 – 8,575 = 1,8 gam , số mol H2O bị điện phân 0,1 mol.
- Phương trình điện phân của H2O :
2H2O → N a O H d p d d 2H2↑ + O2↑ (3)
(mol) 0,1 0,1 0,05
- tính số mol electron trao đổi anot : Cl2 (0,075 mol, O2 (0,05 mol).
Số mol electron trao đổi = 2.0,075 + 4.0,05 = 0,35 mol.
Hoặc tại catot : Cu (0,05 mol) , H2 (0,025 + 0,1) mol cũng tương tự
Số mol electron trao đổi = 2.0,05 + 2.0,125 = 0,35 mol.
ne = It/26,8 , thay số : 0,35 = 1,34t/26,8 => t = 7.

Đáp án : B
nCuSO4 = x ; nNaCl = 3x mol
Catot :
Cu2+ + 2e -> Cu
,x 2x
2H2O + 2e -> 2OH- + H2
, x = 0,05 0,05
Anot :
2Cl- -> Cl2 + 2e
,3x 1,5x 3x
2H2O -> 4H+ + O2 + 4e
(Al + dd X => H2 => Chứng tỏ có H+ hoặc OH- nhưng vì nCl- = 3nCu2+ nên theo thứ tự điện phân thì Catot điện phân nước trước)
( nOH = 2/3nH2 = 0,05 mol )
Dung dịch chứa 2 chất tan là Na2SO4 và NaOH (Cl- điện phân hết)
,mgiảm = mCu + mCl2 + mH2O đp + mH2
=> nH2O đp = 0,1 mol => nO2 = 0,05 mol
=> ne trao đổi = nCl- + 4nO2 = 0,35 mol
=> t = 7 h

Đáp án : B
Gọi số mol CuSO4 và NaCl lần lượt là 2x và 5x mol
Chất tan trong dung dịch chắc chắn có Na2SO4
Vì dung dịch Y phản ứng với Al tạo khí
mà nCl > 2nCu
=> chắc chắn chất còn lại là NaOH
=> Cu2+ và Cl- bị điện phân hết
Các quá trình có thể xảy ra
Catot :
Cu2+ + 2e -> Cu
2H2O + 2e -> H2 + 2OH-
Anot :
2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
n O H = 2 / 3 n H 2 = 0 , 1 m o l
Vì sau khi điện phân sau các quá trình trên chỉ là điện phân H2O
-> H2 và O2 không ảnh hưởng đến các ion trong dung dịch
=> nOH + 2nCu = nCl
=> 0,1 + 4x = 5x
=> x = 0,1 mol
m g i ả m = m C u + m C l 2 + m H 2 + m H 2 O
⇒ n H 2 O đ p s a u = 0 , 1 m o l
⇒ n e t r a o đ ổ i = 0 , 7 m o l
=> t = 9,72h

Chọn đáp án D.
Đặt số mol của CuSO4 là a, của NaCl là 3a.
Phương trình điện phân:
C u 2 + + 2 C l - → C u + C l 2
2 C l - + 2 H 2 O → C l 2 + H 2 + 2 O H -
Sau khi điện phân t giờ, dung dịch Y chứa 2 chất tan là Na2SO4 và NaOH
⇒ C u 2 + , C l - đều bị điện phân hết.
Có n O H - = 2 3 n H 2 = 0 , 15 m o l ⇒ a = 0 , 15 m o l
64 a + 35 , 5 . 3 a + 2 . 0 , 075 = 25 , 725 < 27 , 525
=> Chứng tỏ đã xảy ra điện phân nước.
Số mol nước điện phân = 27 , 525 - 25 , 725 18 = 0 , 1 m o l
⇒ t = 6 , 5 giờ



Đáp án A