Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
nKhí ở anot = 0,14 > 0,24/2 Þ Có tạo O2 với nO2 = 0,14 – 0,24/2 = 0,02
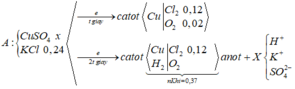
Tại t giây có ne = 0,12 x 2 + 0,02 x 4 = 0,32 Þ Tại 2t giây có ne = 0,32 x 2 = 0,64
Þ nO2 tại 2t giây = (0,64 - 0,12 x 2)/4 = 0,1 Þ nH2 = 0,37 - 0,12 - 0,1 = 0,15
Þ nCu tại 2t giây = 0,64/2 - 0,15 = 0,17 Þ x = 0,17 Þ nSO42- trong X = 0,17
BTNT.K Þ nK+ = 0,24; BTĐT trong X Þ nH+ = 0,17 x 2 - 0,24 = 0,1 Þ [H+] = 0,1M Þ pH = y = 1

Đáp án D
Thời gian điện phân t:
n k h í = 3 , 136 22 , 4 = 0,14 mol
Anot:
Cl- → Cl2 +2e
0,24 0,12 0,24 mol
H2O → H+ + O2 + 4e
0,02 0,08 mol
ne trao đổi = 0,32 mol
ne trao đổi = I t F
=> thời gian 2t, ne trao đổi = 0,64 mol
thời gian điện phân 2t nkhí = 0,37 mol
khi đó anot :
Cl- → Cl2 + 2e
0,24 0,12 0,24 mol
H2O → H+ + O2 + 4e
0,1 0,4 mol
=> n H 2 = 0,37- 0,12 – 0,1 = 0,15 mol
catot:
Cu2+ +2e → Cu
x 2x x mol
H2O + 2e → 2OH- + H2
0,15 0,3 0,3 0,15 mol
2x+0,3 = 0,64
=> x = 0,17 mol
mặt khác
nH+ =0,1 mol ⇒ [H+] = 0,1
⇒ pH = 1

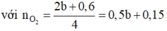
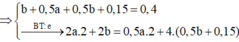
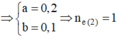
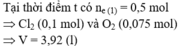
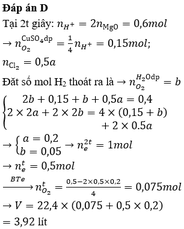


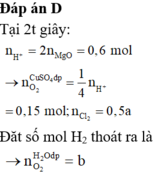

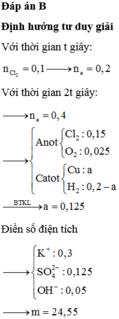
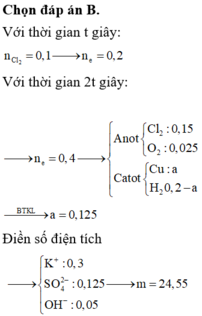

Đáp án B
► Dung dịch thu được không pứ với AgNO₃
⇒ dung dịch thu được không còn Cl⁻
Ở đây ta cần chú ý, với H⁺ bị điện phân tại
catot và anot bị điện phân H₂O thì:
2H⁺ + 2e → H₂
2H₂O → 4H⁺ + O₂ + 4e
⇒ cộng lại cho khử e thì:
2H₂O → 2H₂ + O₂
⇒ xem như điện phân H₂O
⇒ pH không đổi
Mà ta thấy sau t(s) đầu tới t(s) sau
thì pH bị thay đổi
⇒ H₂O và H⁺ không bị điện phân
cùng lúc ngay t(s) đầu
► Mặt khác, phần xem như điện
phân H₂O không cần quan tâm
vì không có gì đặc biệt
⇒ xét phần còn lại thấy
nH⁺ giảm = nH⁺ bị điện phân
= 0,1 – 0,01 = 0,09 mol
nH⁺ sau khi điện phân
t(s) = 0,1 mol = nHCl ban đầu
⇒ nCl⁻ = 0,1 mol
BTe: nCu = (0,1 – 0,09) = 0,005 mol