Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B.
CO2, SO2 đều là oxit axit nên phản ứng dễ dàng với các dd kiềm, nên có thể dùng Ca(OH)2, NaOH để loại bỏ 2 khí này. Nếu dùng dung dịch KMnO4 hoặc nước Br2 thì không loại bỏ được khí CO2, và còn làm mất C2H4

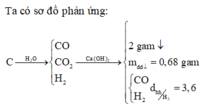
Tóm tắt:
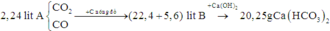
Quan sát – định hướng: Khi cho A qua than nóng đỏ thì chỉ có CO2 tham gia phản ứng tạo CO. Vậy thể tích tăng là do chính phản ứng này tạo ra lượng khí CO nhiều hơn lượng khí CO2 tham gia phản ứng. Đề không cho là phản ứng hoàn toàn và thêm dữ kiện phản ứng với Ca(OH)2.
Chắc chắn trong B còn một lượng khí CO2 chưa phản ứng. Khi cho B qua Ca(OH)2 thì chỉ có CO2 phản ứng được với Ca(OH)2. Qua 2 lần phản ứng đều chỉ có CO2 tham gia phản ứng và qua 2 lần thì CO2 hết.
Từ đó hoàn toàn có thể tính được số mol của CO2.
Ta có phương trình phản ứng:
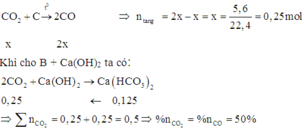
Đáp án D

Phương pháp:
- Tính số mol CO và H2.
- m↓ - mCO2 = m dung dịch giảm => mCO2
- Viết PTHH. Tính toán theo PTHH.
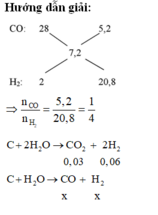
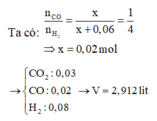
Đáp án C

Đáp án C
Đặt nCO= x mol; n C O 2 = y mol trong hỗn hợp X
→ x+ y= 22,4/22,4= 1mol (1)
CO2+ C → t 0 2CO
z z 2z mol
Khí Y chứa 2z+x mol khí CO và y-z mol khí CO2
nY - nX = 7,84/22,4 = 0,35 mol
→ nY = 0,35+ 1 = 1,35 mol
→ 2z +x + y-z = 1,35→ x+ y + z = 1,35 mol (2)
2CO2+ Ca(OH)2 → Ca(HCO3)2
Ta có: n C O 2 = 2. n C a ( H C O 3 ) 2 = 2.20,25/162 = 0,25 mol
→ y - z = 0,25 (3)
Từ (1,2,3) ta có x = 0,4; y = 0,6; z = 0,35 mol
→ % V C O = % n C O = 0 , 4 1 . 100 % = 40 %


Giải thích:
Vì CO và oxi trung tính và CO2 là 1 oxit axit.
⇒ Giải pháp tối ưu là tác dụng với 1 dung dịch bazo.
⇒ Chọn Ca(OH)2 vì giá thành rẻ ⇒ Chọn A
Đáp án A