Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b) Ta có: \(n_{Zn}=\dfrac{97,5}{65}=1,5\left(mol\right)=n_{H_2}\)
\(\Rightarrow V_{H_2}=1,5\cdot22,4=33,6\left(l\right)\)
c) Khử 120 gam gì vậy bạn ??
a) PTHH: Zn+2HCl→ZnCl2+H2↑Zn+2HCl→ZnCl2+H2↑
b) Ta có: nZn=97,565=1,5(mol)=nH2nZn=97,565=1,5(mol)=nH2
⇒VH2=1,5⋅22,4=33,6(l)
c) ???

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,3}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe_2O_3\left(pư\right)}=\dfrac{1}{3}n_{H_2}=0,1\left(mol\right)\Rightarrow n_{Fe_2O_3\left(dư\right)}=0,3-0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,2.160=32\left(g\right)\)

1.\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
2.\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,2 ( mol )
0,15 0,15 ( mol )
\(m_{Cu}=0,15.64=9,6g\)

a)\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
b)\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,15 0,1 0 0
0,1 0,1 0,1 0,1
0,05 0 0,1 0,1
\(CuO\) dư và dư 0,05mol
\(\Rightarrow m_{CuOdư}=0,05\cdot80=4g\)
a.\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,1 ( mol )
\(V_{H_2}=n_{H_2}.22,4=0,1.22,4=2,24l\)
b.\(n_{CuO}=\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,1 ( mol )
Chất còn dư là \(CuO\)
\(m_{CuO\left(du\right)}=n_{CuO\left(du\right)}.M_{CuO}=\left(0,15-0,1\right).80=4g\)

nZn=19,5/65=0,3(mol)
mHCl=18,25/36,5=0,5(mol)
pt: Zn+2HCl--->ZnCl2+H2
1______2
0,3_____0,5
Ta có: 0,3/1>0,5/2
=>Zn dư
mZn dư=0,05.65=3,25(mol)
Theo pt: nH2=1/2nHCl=1/2.0,5=0,25(mol)
=>VH2=0,25.22,4=5,6(l)
nZn = 0,3 mol
nHCl = 0,5 mol
Zn + 2HCl → ZnCl2 + H2
Đặt tỉ lệ ta có
0,3 < \(\dfrac{0,52}{2}\)
⇒ Zn dư và dư 3,25 gam
⇒ VH2 = 0,25.22,4 = 5,6 (l)

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{HCl}=0,25\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{HCl\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=22,4\cdot0,1=2,24\left(l\right)\\m_{HCl\left(dư\right)}=0,05\cdot36,5=1,825\left(g\right)\end{matrix}\right.\)

nFe= 11,2 : 56 = 0,2 (mol)
pthh : Fe + 2HCl --> FeCl2 + H2(phan ung the )
0,2 -----------------------> 0,2 (mol)
=> VH2 = 0,2 . 22,4 = 4,48 ( l)
pthh : CuO + H2 -t--> Cu +H2O
0,2---> 0,2 (mol)
=> mCu = 0,2 . 64 = 12,8 (mol)

Số mol của kẽm
nZn = \(\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
Pt : Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,3 0,4 0,2 0,2
a) Lập tỉ số só sánh : \(\dfrac{0,3}{1}>\dfrac{0,4}{2}\)
⇒ Zn dư , HCl phản ứng hết
⇒ Tính toán dựa vào số mol của HCl
Số mol dư của kẽm
ndư = nban đầu - nmol
= 0,3 - (\(\dfrac{0,4.1}{2}\))
= 0,1 (mol)
Khối lượng dư của kẽm
mdư = ndư . MZn
= 0,1 . 65
= 6,5 (g)
b) Số mol của khí hidro
nH2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
Số mol của muối kẽm clorua
nZnCl2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của muối kẽm clorua
mznCl2 = nZnCl2 . MZnCl2
= 0,2. 136
= 27,2 (g)
c) 4H2 + Fe3O4 → (to) 3Fe + 4H2O\(|\)
4 1 3 4
0,2 0,15
Số mol của sắt
nFe = \(\dfrac{0,2.3}{4}=0,15\left(mol\right)\)
Khối lượng của sắt
mFe = nFe. MFe
= 0,15 . 56
= 8,4 (g)
Chúc bạn học tốt
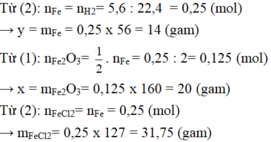
a, nZn = 97,5/65 = 1,5 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
nH2 = nZn = 1,5 (mol)
VH2 = 1,5 . 22,4 = 33,6 (l)
b, nFe2O3 = 120/160 = 0,75 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
LTL: 0,75 > 1,5/3 => Fe2O3 dư
nFe2O3 (p/ư) = 1,5/3 = 0,5 (mol)
mFe2O3 (dư) = (0,75 - 0,5) . 160 = 40 (g)
a. \(n_{Zn}=\dfrac{97.5}{65}=1,5\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
1,5 1,5
b. \(V_{H_2}=1,5.22,4=33,6\left(l\right)\)
c. \(n_{Fe_2O_3}=\dfrac{120}{160}=0,75\left(mol\right)\)
PTHH : Fe2O3 + 3H2 -> 2Fe + 3H2O
0,5 1,5
Ta thấy \(\dfrac{0.75}{1}>\dfrac{1.5}{3}\) => Fe2O3 dư
\(m_{Fe_2O_3\left(dư\right)}=\left(0,75-0,5\right).160=40\left(g\right)\)
\(V_{Fe_2O_3\left(dư\right)}=0,5.22,4=11,2\left(l\right)\)