Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Kết tủa vàng chính là S
Trong môi trường axit, Mn+7 bị khử về Mn+2

Chọn A
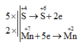
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + 2H2SO4 + K2SO4
→ Các hệ số của KMnO4 và H2SO4 lần lượt là 2 và 2

a)
- Quá trình oxi hóa: \(\overset{-1}{2Cl}\rightarrow\overset{0}{Cl_2}+2e\) (Nhân với 5)
- Quá trình khử: \(\overset{+7}{Mn}+5e\rightarrow\overset{+2}{Mn}\) (Nhân với 2)
PTHH: \(16HCl+2KMnO_4\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
b)
- Quá trình oxi hóa: \(\overset{+4}{S}\rightarrow\overset{+6}{S}+2e\) (Nhân với 5)
- Quá trình khử: \(\overset{+7}{Mn}+5e\rightarrow\overset{+2}{Mn}\) (Nhân với 2)
PTHH: \(5SO_2+2KMnO_4+2H_2O\rightarrow K_2SO_4+2MnSO_4+2H_2SO_4\)
c)
- Quá trình oxi hóa: \(\overset{+2}{2Fe}\rightarrow\overset{+3}{Fe_2}+2e\) (Nhân với 5)
- Quá trình khử: \(\overset{+7}{Mn}+5e\rightarrow\overset{+2}{Mn}\) (Nhân với 2)
PTHH: \(10FeSO_4+2KMnO_4+8H_2SO_4\rightarrow K_2SO_4+2MnSO_4+5Fe_2\left(SO_4\right)_3+8H_2O\)
d)
- Quá trình oxi hóa: \(\overset{+2}{2Fe}\rightarrow\overset{+3}{Fe_2}+2e\) (Nhân với 3)
- Quá trình khử: \(\overset{+6}{Cr_2}+6e\rightarrow\overset{+3}{Cr_2}\) (Nhân với 1)
PTHH: \(6FeSO_4+K_2Cr_2O_7+7H_2SO_4\rightarrow K_2SO_4+Cr_2\left(SO_4\right)_3+3Fe_2\left(SO_4\right)_3+7H_2O\)

Đáp án C.
Các phương trình oxi hóa khử là I, II, III, IV.
Các pt phản ứng xảy ra:

YTHH 05: Cân bằng nhanh theo bảo toàn nguyên tố:
1.KMnO4 thì sinh 1. MnSO4 và có 4.O chuyển hết về 4.H2O
Bảo toàn H suy ra có 4.H2SO4; bảo toàn S suy ra có 3.K2SO4; bảo toàn K suy ra có 5.KCl
Vậy KMnO4 + 4H2SO4 + 5KCl ® 3K2SO4 + MnSO4 + 2,5Cl2 + 4H2O
® tỉ lệ cần xác định là 1:5. Đáp án B.
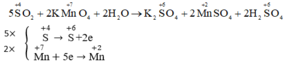
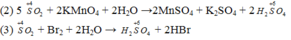

SO2 là chất khử, KMnO4 là chất oxi hóa.