Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Fe_xO_y+yCO\rightarrow xFe+yCO_2\left(1\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\left(2\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\left(3\right)\)
Theo (2): \(n_{CO_2}=n_{CaCO_3}=\dfrac{8}{100}=0,08\left(mol\right)\)
Theo (3): \(n_{Fe}=n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Theo (1), ta có:
\(\dfrac{x}{y}=\dfrac{n_{Fe}}{n_{H_2SO_4}}=\dfrac{0,06}{0,08}=\dfrac{3}{4}\Rightarrow x=3;y=4\)
CT: Fe3O4

a) nCaCO3 = 0.3 (mol)
CO + O => CO2
=> nO = 0.3 (mol)
mFe = moxit - mO = 16 - 0.3*16 = 11.2 (g)
nFe = 11.2/56 = 0.2 (mol)
nFe : nO = 0.2 : 0.3 = 2 : 3
CT oxit : Fe2O3

a) \(n_{HCl}=0,4.1=0,4\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4 0,2
b, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
c, \(n_{Cu\left(tt\right)}=\dfrac{10,24}{64}=0,16\left(mol\right)\)
PTHH: H2 + CuO → Cu + H2O
Mol: 0,2 0,2
\(\Rightarrow H=\dfrac{n_{Cu\left(tt\right)}}{n_{Cu\left(lt\right)}}=\dfrac{0,16}{0,2}.100\%=80\%\)

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


O2 + C → t ∘ dư 2CO
Khí X là CO
Khi cho CO qua Al2O3 và Fe2O3 chỉ có Fe2O3 bị CO khử
Fe2O3 + 3CO → t ∘ 2Fe + 3CO2↑
Khí Y là CO2
Hỗn hợp rắn Z: Fe, Al2O3, có thể có Fe2O3 dư
Khí Y + Ca(OH)2 dư chỉ tạo ra muối trung hòa
CO2 + Ca(OH)2 → CaCO3↓trắng + H2O
Cho hỗn hợp Z vào H2SO4 loãng dư, không thấy có khí thoát ra => trong Z chắc chắn có Fe2O3 dư
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O

Đặt CTHH của oxit là RO
Ta có: \(n_{CaCO_3}=n_{kt}=\dfrac{50}{100}=0,5\left(mol\right)\)
PTHH:
\(RO+CO\xrightarrow[]{t^o}R+CO_2\)
0,5<-----------------0,5
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,5<-----0,5
\(\Rightarrow M_{RO}=\dfrac{36}{0,5}=72\left(g/mol\right)\\ \Rightarrow M_R=72-16=56\left(g/mol\right)\)
Vậy R là Fe. CTHH của oxit sắt là FeO
Chọn C
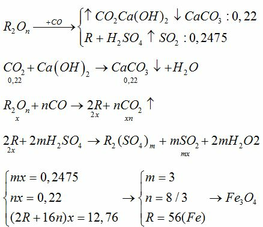
$CO + O_{oxit} \to CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{O(oxit)} = n_{CaCO_3} = \dfrac{8}{100} = 0,08(mol)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
Ta có :
$n_{Fe} : n_O = 0,06 : 0,08 = 3 : 4$
Vậy oxit là $Fe_3O_4$
Công thức oxit sắt có dạng: \(Fe_xO_y\)
\(Fe_xO_y+yCO\rightarrow xFe+yCO_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(\Rightarrow n_{Fe}=n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
\(\Rightarrow n_{CO}=n_{CO_2}=n_{CaCO_3}=0,08\left(mol\right)\)
\(\Rightarrow n_{O\left(Fe_xO_y\right)}=n_{O\left(CO_2\right)}-n_{O\left(CO\right)}=2n_{CO_2}-n_{CO}=0,08\left(mol\right)\)
\(\Rightarrow n_{Fe}:n_O=0,06:0,08=3:4\)
\(\Rightarrow Fe_3O_4\)