Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng các chất sau phản ứng :
Số mol các chất đã dùng :
n SO 2 = 1,12/22,4 = 0,05 mol; n Ca OH 2 = 0,1x700/1000 = 0,07 mol
Theo phương trình hoá học, lượng Ca OH 2 đã dùng dư. Do đó khối lượng các chất sau phản ứng được tính theo lượng SO 2
0,05 mol SO 2 tác dụng với 0,05 mol Ca OH 2 sinh ra 0,05 mol CaSO 3 và dư 0,07 - 0,05 = 0,02 (mol) Ca OH 2
Khối lượng các chất sau phản ứng là :
m CaSO 3 = 120 x 0,05 = 6 (gam)
m Ca OH 2 = 74 x 0,02 = 1,48 (gam)

Số mol của lưu huỳnh đioxit ở dktc
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
700ml = 0,7l
Số mol của dung dịch canxi hidroxi CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_m.V=0,1.0,7=0,07\left(mol\right)\)
Pt : SO2 + Ca(OH)2 → CaSO3 + H2O\(|\)
1 1 1 1
0,05 0,07 0,05
a) Tên muối tạo thành là : canxi sunfit
b) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,07}{1}\)
⇒ SO2 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol của SO2
Số mol của muối canxi sunfit
nCaSO3 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của muối canxi sunfit
mCaSO3 = nCaSO3 . MCaSO3
= 0,05 . 120
= 6 (g)
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,07 - (0,05 . 1)
= 0,02 (mol)
Khối lượng dư của dung dịch canxi hidroxit
mdư = ndư . MCa(OH)2
= 0,02 . 74
= 1,48 (g)
Chúc bạn học tốt

a)SO2 +Ca(OH)2---->CaSO3 +H2O
0,1---------0,1----------------0,1--0,1
b) n\(_{SO2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
n\(_{Ca\left(OH\right)2}=0,7.0,15=0,105\left(mol\right)\)
=> Ca(OH)2 dư
Thwo pthh
n\(_{NaOH}dư=0,105=0,1=0,05\left(mol\right)\)
m\(_{NaOH}dư=0,05.40=2\left(g\right)\)
m\(_{CaSO3}=0,1.120=12\left(g\right)\)
Chúc bạn học tốt
PTHH :2SO2+Ca(OH)2\(\rightarrow\)Ca(HSO)3
b,nSO2 = 0,1 mol
=> n Ca(OH)2 = 0,1(mol)
=> n NaOH = 0,05 (mol)
mNaOH = 0,05.40 = 2(g)
=> mCaSO3 = 12(g)

Chọn C

S O 2 hết, Ca( O H ) 2 dư, phản ứng tạo muối CaS O 3
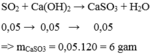

\(a)112ml=0,112l\\ n_{SO_2}=\dfrac{0,112}{22,4}=0,005mol\\ n_{Ca\left(OH\right)_2}=0,7.0,01=0,007mol\\ T=\dfrac{0,007}{0,005}=1,4\\ \Rightarrow tạo.CaSO_3\\ SO_2+Ca\left(OH\right)_2\rightarrow CaSO_3+H_2O\\ b)\Rightarrow\dfrac{0,007}{1}>\dfrac{0,005}{1}\Rightarrow Ca\left(OH\right)_2.dư\\ n_{CaSO_3}=n_{Ca\left(OH\right)_2pư}=n_{SO_2}=0,005mol\\ m_{CaSO_3}=0,005.120=0,6g\\ m_{Ca\left(OH\right)_2dư}=\left(0,007-0,005\right).74=0,148g\)

Số mol của khí lưu huỳnh đioxit
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
300ml = 0,3l
Số mol của dung dịch canxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=0,2.0,3=0,06\left(mol\right)\)
a) Pt : SO2 + Ca(OH)2 → CaSO3 + H2O\(|\)
1 1 1 1
0,05 0,06 0,05
b) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,06}{1}\)
⇒ SO2 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol SO2
Số mol của canxi sunfit
nCaSO3 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của canxi sunfit
mCaSO3 = nCaSO3 . MCaSO3
= 0,05 . 120
= 6 (g)
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,06 - (0,05.1)
= 0,01 (mol)
Khối lượng của dung dịch canxi hidroxit
mdư = ndư . MCa(OH)2
= 0,01 . 74
= 0,74 (g)
c) Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng= 1,12 + 0,3
= 1,42 (l)
Nồng độ mol của canxi sunfit
CMCaSO3 = \(\dfrac{n}{V}=\dfrac{0,05}{1,42}=0,04\left(M\right)\)
Nồng độ mol của dung dịch cnaxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}=\dfrac{0,01}{1,42}=0,007\left(M\right)\)
Chúc bạn học tốt
Mình xin lỗi bạn nhé , bạn sửa lại chữ ' cnaxi ' thành ' canxi ' giúp mình
a, SO2 + Ca(OH)2--> CaSO3 + H2O
b, Ta có nSO2=1,12/22,4=0,05 mol
nCa(OH)2=0,1.0,7=0,07 mol
Ta có tỉ lệ : nSO2/1< nCa(OH)2/1
=> Ca(OH)2 dư , CO2 hết
=> nCa(OH)2 PỨ= nCaSO3=nSO2=0,05 mol=nH2O
=> mCa(OH)2 dư=(0,07-0,05).74=1,48 g
mCaSO3=0,05.120=6 g
mH2O=0,05.18=0,9 g
nSO2=1,12:22,4=0,05mol
nCa(OH) 2=0,1.0,7=0,07mol
SO2+Ca(OH)2--->CaSO3+H2O
0,05mol 0,07mol
0,05mol -->0,05mol -->0,05mol -->0,05mol
mCaSO3=0,05.120=6g
mH2O=0,05.18=0,9g