Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tốc độ tức thời của phản ứng:
\(v=k\left[NO\right]^2.\left[O_2\right]\)
a,
Khi tăng nồng độ NO lên gấp đôi:
\(v=k\left(2\left[NO\right]\right)^2.\left[O_2\right]=4k\left[NO\right]^2.\left[O_2\right]\)
Vậy tốc độ tăng gấp 4 lần
b,
Khi thể tích giảm 1 nửa, nồng độ mỗi chất tăng gấp đôi:
\(v=k\left(2\left[NO\right]\right)^2.2\left[O_2\right]=8k\left[NO\right]^2.\left[O_2\right]\)
Vậy tốc độ tăng gấp 8 lần
c,
Độ tăng nhiệt:
\(\Delta t^o=1900-400=1500\)
Với mỗi lần tăng nhiệt độ 150oC, tốc độ tăng 3 lần.
Vậy khi tăng nhiệt độ 10 lần như vậy, tốc độ tăng 310 = 59049 lần

Áp suất tăng 3 lần, nhiệt độ không đổi thì thể tích giảm 3 lần nên nồng độ tăng 3 lần
Vậy tốc độ phản ứng tăng: 3.3.3 = 27 (lần)

(a) v tăng lên 83 lần
(b) v tăng lên 23 = 8 lần
(c) v tăng lên 4.22 = 16 lần
(d) v tăng lên 42/2 = 8 lần
Đáp án B

a) Biểu thức tốc độ tức thời của phản ứng là:
v1 = k.CCl2.CH2
b) Gọi CCl2 là nồng độ ban đầu của Cl, CH2 là nồng độ đầu của H2
=> v2 = k. CCl2.CH2 :2
=> 2v2 = v1
=> Tốc độ phản ứng giảm 1 nửa khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2

Áp dụng định luật tác dụng khối lượng: v = kCH2.CI2
=> Ở một nhiệt độ không đổi, tốc độ phản ứng (6) tỉ lệ thuận với nồng độ của H2 cũng như nồng độ của I2
=> Nếu nồng độ của H2 tăng gấp đôi thì tốc độ phản ứng (6) tăng gấp đôi
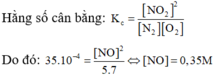
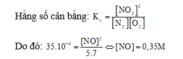
a) Công thức tính tốc độ tức thời của phản ứng là: v1 = k.CNO2.CO2
b)
- Nồng độ O2 tăng 3 lần, nồng độ NO không đổi: v2 = k.CNO2.(CO2.3)
=> v2 tăng 3 lần so với v1
- Nồng độ NO tăng 3 lần, nồng độ O2 không đổi: v3 = k.(CNO.3)2.CO2 = k.CNO2.9.CO2
=> v3 tăng 9 lần so với v1
- Nồng độ NO và O2 đều tăng 3 lần: v4 = k.(CNO.3)2.(CO2.3) = k.CNO2.27.CO2
=> v4 tăng 27 lần so với v1