Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Giả sử có 100 gam quặng → mCa3(PO4)2 = 93 gam.
Ca3(PO4)2 + 2H2PO4 → Ca(HPO4)2 + 2 CaSO4 <=> P2O5
310-----------2 x 98------------------------------------142
93--------------x----------------------------------------y
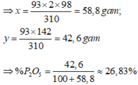

Ta có thành phần chính của quặng: Ca3(PO4)2.
Phương trình: Ca3(PO4)2 + 2H2SO4 -> Ca(H2PO4)2 + 2CaSO4
Đặt m gồm nCa3PO4 = 0,93 mol và phần tạp chất có khối lượng tương đương 0,07 mol Ca3PO4 thu sau
phản ứng có 0,93 mol Ca(HPO4)2 và 1,86 mol CaSO4 và tạp chất có m = 21,7
Tính độ dinh dưỡng của phân lân => quy về P2O5
% dinh dưỡng = 142 . 0,93 / (0,93 . 232 + 1,86 . 136 + 21,7) = 26,83%.=> Đáp án B

Đáp án B
Giả sử khối lượng phân là 100g ⇒ mCa3(PO4)3 = 35 gam.
Bảo toàn nguyên tố ta có: Ca3(PO4)2 → P2O5.
⇒ mP2O5 = 35 × 142/310 = 16,03 gam.
⇒ Độ dinh dưỡng của phân bón đã cho = 16,03×100/100 = 16,03%.

Xét 100g phân lân => m Ca(H2PO4)2 = 98g
Cứ 234g Ca(H2PO4)2 có 62g P qui về 142g P2O5
Vậy 98g Ca(H2PO4)2 có 25,97g P qui về 59,47g P2O5
=>độ dinh dưỡng = 59,47%
=>B


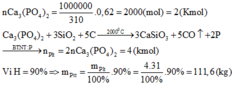



Chọn B