Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Rắn không tan là Al dư => mAl dư = 1,35 (g)
nH2 = 2,24 : 22,4 = 0,1 (mol)
Gọi số mol Na = số mol Al pư = a (mol)
BT e ta có: nNa + 3nAl = 2nH2 => a + 3a = 2. 0,1
=> a = 0,05 (mol)
=> m = mNa + mAl pư + mAl dư = 0,05.23 + 0,05.27 + 1,35 = 3,85 (g)
Đáp án B

Đáp án B
Rắn không tan là Al dư
=> mAl dư = 1,35 (g)
nH2 = 2,24 : 22,4 = 0,1 (mol)
Gọi số mol Na = số mol Al pư = a (mol)
BT e ta có: nNa + 3nAl = 2nH2
=> a + 3a = 2. 0,1
=> a = 0,05 (mol)
=> m = mNa + mAl pư + mAl dư = 0,05.23 + 0,05.27 + 1,35 = 3,85 (g)

nH2 = \(\dfrac{V_{H^2}}{22,4}\) = \(\dfrac{2,24}{22,4}\) = 0,1 (mol)
n = \(\dfrac{m_{NaAlO_2}}{M_{NaAlO_2}}\) = \(\dfrac{1,35}{82}\) \(\approx\) 0,02 (mol)
Ta có phương trình hoá học:
2NaOH + 2Al + 2H2O \(\underrightarrow{t^0}\) 2NaAlO2 + 3H2
PT: 2 : 2 : 2 : 2 : 3 (mol)
ĐB: \(\dfrac{0,02}{2}\) < \(\dfrac{0,1}{3}\) (mol)
⇒ H2 dư, mọi tính toán dựa vào số mol của NaAlO2
Ta có phương trình hoá học:
2NaOH + 2Al + 2H2O \(\underrightarrow{t^0}\) 2NaAlO2 + 3H2
PT: 2 : 2 : 2 : 2 : 3 (mol)
ĐB: 0,02: 0,02: 0,02 : 0,02 : 0,03 (mol)
mNaOH = nNaOH . MNaOH = 0,02 . 40 = 0,8 (g)
mAl = nAl . MAl = 0,02 . 27 = 0,54 (g)
Vậy mNaOH = 0,8 g, mAl = 0,54 g.
* Chú thích: PT là phương trình, ĐB là đề bài.
Dòng 2 bị thiếu nên đây là dòng 2 được viết lại ạ: \(n_{NaAlO_2}\) = \(\dfrac{m_{NaAlO_2}}{M_{NaAlO_2}}=\dfrac{1,35}{82}\approx0,02\left(mol\right)\)

Áp dụng định luật bảo toàn khối lượng ta có:
\(m=m_{ACl_n}+m_{BCl_m}=m_{A+B}+m_{HCl}-m_{H_2}\)
Áp dụng bảo toàn nguyên tố:
nHCl phản ứng = 2nH2 = 0,2 mol
Ta có m = 10 + 0,2 x 36,5 - 0,2 = 17,1 (g)
Chọn đáp án B

Giải thích:
Gọi số mol của Na và Al lần lượt là x và 2x (mol)
Na + H2O → NaOH + 0,5H2
x x 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5H2
x ← x → x → 1,5x
nH2 = 0,4 => 0,5x + 1,5x = 0,4 => x = 0,2
Chất rắn không tan là Al dư: nAl dư = 2x – x = x = 0,2 mol
=> m = mAl dư = 27.0,2 = 5,4 gam
Đáp án D
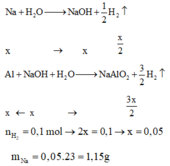
Đáp án cần chọn là: A