Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

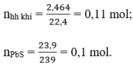
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

a)Fe + 2HCl ->FeCl2 + H2\(\uparrow\)
0.01 0.01
FeS + 2HCl ->FeCl2 + H2S\(\uparrow\)
0.1 0.1
H2S + Pb(NO3)2->PbS \(\downarrow\) + 2HNO3
0.1 0.1
nPbS =2.39/239=0.1 mol , n (hỗn hợp khí) =2.464/22.4=0.11 mol
n(H2)+n(H2S)=0.11 ->n(H2)=0.01 mol
V(H2)=n * 22.4 = 0.01*22.4=0.224(l)
V(H2S)=n*22.4=0.1*22.4=2.24(l)
m(Fe)=n*M=0.01*56=0.56(g)
m(FeS)=n*M=0.1*88=8.8(g)

nhh=0,11 mol
n PbS=0,1 mol
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.

Fe+2HCl→FeCl2+H2↑(1)0,01←0,01FeS+2HCl→FeCl2+H2S(2)0,1←0,1H2S+Pb(NO3)2→PbS↓+2HNO3(3)0,10,1Fe+2HCl→FeCl2+H2↑(1)0,01←0,01FeS+2HCl→FeCl2+H2S(2)0,1←0,1H2S+Pb(NO3)2→PbS↓+2HNO3(3)0,10,1
b) Hỗn hợp khí gồm H2 và khí H2S
Số mol PbS : 23,9239=0,1(mol);23,9239=0,1(mol);
số mol H2S và H2: 2,46422,4=0,11(mol)2,46422,4=0,11(mol)
⇒⇒ Số mol H2 : 0,11 – 0,1 = 0,01 (mol)
Tỉ lệ số mol 2 khí : nH2nH2S=0,010,1=110.nH2nH2S=0,010,1=110.
c) Theo các phản ứng (1) và (2) ta có :
nFe=nH2=0,01mol⇒mFe=0,01.56=0,56(g)nFeS=nH2S=0,1mol⇒mFeS=0,1.88=8,8(g)⇒%mFe=0,56(0,56+8,8).100%=5,98%%mFeS=94,02%.nFe=nH2=0,01mol⇒mFe=0,01.56=0,56(g)nFeS=nH2S=0,1mol⇒mFeS=0,1.88=8,8(g)⇒%mFe=0,56(0,56+8,8).100%=5,98%%mFeS=94,02%.

\(n_{PbS}=\dfrac{47,8}{239}=0,2\left(mol\right)\)
Bảo toàn S: \(n_{FeS}=n_{H_2S}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{6,72}{22,4}-0,2=0,1\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,1<----------------------0,1
=> mFe = 0,1.56 = 5,6 (g)
mFeS = 0,2.88 = 17,6 (g)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{5,6+17,6}.100\%=24,138\%\\\%m_{FeS}=\dfrac{17,6}{5,6+17,6}.100\%=75,862\%\end{matrix}\right.\)

a, PT: \(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(H_2S+Pb\left(NO_3\right)_2\rightarrow2HNO_3+PbS_{\downarrow}\)
b, Hỗn hợp khí thu được gồm: H2, H2S.
Ta có: \(n_{PbS}=\dfrac{23,9}{239}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2S}=n_{PbS}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2}=\dfrac{2,464}{22,4}-0,1=0,01\left(mol\right)\)
⇒ Tỉ lệ số mol H2: H2S = 0,01:0,1 = 1:10
c, Theo PT: \(\left\{{}\begin{matrix}n_{FeS}=n_{H_2S}=0,1\left(mol\right)\\n_{Fe}=n_{H_2}=0,01\left(mol\right)\end{matrix}\right.\)
⇒ mhh = mFeS + mFe = 0,1.88 + 0,01.56 = 9,36 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeS}=\dfrac{0,1.88}{9,36}.100\%\approx94,02\%\\\%m_{Fe}\approx5,98\%\end{matrix}\right.\)
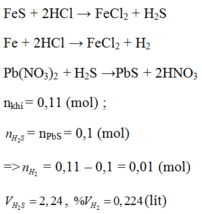
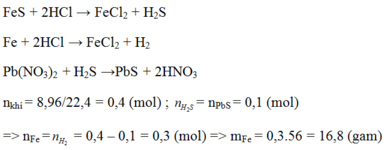
Vì khí cho hỗn hợp khí vào dung dịch Pb(NO3)2 thì có kết tủa đen
⇒ Hỗn hợp khí có H2S và H2
Có nPbS = 23,9/239 = 0,1 mol
PTHH :
Pb(NO3)2 + H2S → PbS + 2HNO3
0,1 0,1 (Mol)
Fe + 2HCl → FeCl2 + H2
0,01 0,01 (Mol)
⇒ nFe = nH2 = 0,01 mol
⇒ mFe = 0,01.56 = 0,56 gam
FeS + 2HCl → FeCl2 + H2S
0,1 0,1 (Mol)
⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1.88 = 8,8 gam
=>VH2S=0,1.22,4=2,24l
%m FeS=\(\dfrac{8,8}{0,56+8,8}100\)=94,02%
=>%m Fe=5,98%
Chị lớp 12 giài bài 11 này đi: https://hoc24.vn/cau-hoi/bai-ankin-giup-mk-voi.5369779678773