Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
C + H2O → t 0 CO + H2 (1)
0,3→ 0,3
C + 2H2O → t 0 CO2 + 2H2 (2)
0,15← (0,6-0,3)
CO2+ Ca(OH)2 → CaCO3+ H2O (3)
3CO + Fe2O3 → t 0 2Fe + 3CO2 (4)
0,3← (0,3-0,2)
3H2 + Fe2O3 → t 0 2Fe + 3H2O (5)
0,60 0,2← 0,6 mol
Ta có: n F e 2 O 3 = 0,3 mol; n H 2 O = 0,6 mol
Tính toán theo phương trình ta có: 0,3 mol CO; 0,15 mol CO2; 0,6 mol H2
→ % V C O 2 = % n C O 2 = n C O 2 n X . 100 % = 0 , 15 0 , 3 + 0 , 15 + 0 , 6 . 100 % = 14 , 28 %

nCuO = 0,9
nH2SO4 = 0,088 ⇒ m dd H2SO4 sau = 0,088.98 : 44% = 19,6g
nH2O = (m dung dịch H2SO4 sau – m dung dịch H2SO4 ban đầu )/18
= (19,6 - 8,8)/18 = 0,6
Đặt nCO =a ; nCO2 =b
Áp dụng định luật bảo toàn e khi cho hơi nước qua than nóng đỏ có:
2a + 4b = 2nH2O = 2 × 0,6 =1,2 (1)
Áp dụng định luật bảo toàn e khi cho X tác dụng với CuO có
2a + 2× nH2 = 2nCu ⇒ 2a + 2nH2O = 2nCu
⇒ a = 0,3 ⇒ b = 0,15
⇒% VCO2 = 0,15 : ( 0,15 + 0,3 + 0,6 ) = 14,29%
Đáp án B

Đáp án C
C + H2O → t 0 CO + H2 (1)
0,12→ 0,12
C + 2H2O → t 0 CO2 + 2H2 (2)
0,075← (0,27-0,12)
CO2+ Ca(OH)2 → CaCO3+ H2O (3)
3CO + Fe2O3 → t 0 2Fe + 3CO2 (4)
0,12← (0,13-0,09)
3H2 + Fe2O3 → t 0 2Fe + 3H2O (5)
0,27 0,09← 0,27 mol
Ta có: n F e 2 O 3 = 0,13 mol; n H 2 O = 0,27 mol
Tính toán theo phương trình ta có: 0,12 mol CO; 0,075 mol CO2; 0,27 mol H2
→ % V C O 2 = % n C O 2 = n C O 2 n X . 100 % = 0 , 075 0 , 12 + 0 , 075 + 0 , 27 . 100 % = 16 , 129 %

Đáp án B
C + H 2 O → t 0 C O + H 2 ( 1 ) 0 , 042 → 0 , 042 m o l C + 2 H 2 O → t 0 C O 2 + 2 H 2 ( 2 ) 0 , 014 ← ( 0 , 07 - 0 , 042 ) C O 2 + C a ( O H ) 2 → C a C O 3 + H 2 O ( 3 ) C O + C u O → t 0 C u + C O 2 ( 4 ) 0 , 042 ← ( 0 , 112 - 0 , 07 ) H 2 + C u O → t 0 C u + H 2 O ( 5 ) 0 , 07 0 , 07 ← 0 , 07
Ta có: nCuO= 0,112 mol; n H 2 O = 0,07 mol
Tính toán theo phương trình ta có: 0,042 mol CO; 0,014 mol CO2; 0,07 mol H2
% V C O 2 = % n C O 2 = n C O 2 n X . 100 % = 0 , 014 0 , 014 + 0 , 042 + 0 , 07 . 100 % = 11 , 11 %

Chọn đáp án C
Y : C u C u O + → + H N O 3 0,4 mol NO
n C u = 3 2 . n N O = 0,6 mol
C O H 2 + O C u O → C u
n C O + n H 2 = n [ O ] C u O = n C u = 0,6 mol. Gọi n C O = x mol; n H 2 = y mol
x + y = 0,6 (1) => n C O 2 = 0,7 – 0,6 = 0,1 mol
Bảo toàn C và H ta có: n H 2 = n H 2 O = n [ O ] H 2 O = 2 n C O 2 + nCO
y = 2.0,1 + x => y – x = 0,2 mol (2)
Từ (1)(2) => x = 0,2; y = 0,4
% V C O = 0 , 2 0 , 7 .100% = 28,57%

Đáp án C
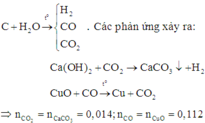
Áp dụng định luật bảo toàn nguyên tố cho nguyên tố C, ta có: n C = n C O + n C O 2 = 0 , 126
Áp dụng định luật bảo toàn mol electron, ta có: 2 n C O + 4 n C O 2 = 2 n H 2 O ⇒ n H 2 O = n C O + 2 n C O 2 = 0 , 14
Vậy tỉ lệ % theo thể tích của CO2 trong A là:
% V C O 2 = 0 , 014 0 , 014 + 0 , 112 + 0 , 14 . 100 % = 5 , 26 %

Đáp án B
Đặt n C O P T 1 = x m o l ; n C O 2 P T 2 = y m o l
C + H 2 O → t 0 C O + H 2 ( 1 ) x x m o l C + 2 H 2 O → t 0 C O 2 + 2 H 2 ( 2 ) y 2 y m o l C O + C u O → t 0 C u + C O 2 ( 3 ) x x m o l H 2 + C u O → t 0 C u + H 2 O ( 4 ) ( x + 2 y ) ( x + 2 y ) m o l
Hỗn hợp khí X có x mol CO, y mol CO2; (x+2y) mol H2
→ x + y + x+ 2y= 15,68/22,4= 0,7 mol hay 2x +3y= 0,7 mol (I)
Tổng số mol Cu là x+x+2y= 2x+ 2y mol
3Cu + 8HNO3 → 3Cu(NO3)2+ 2NO+ 4H2O (1)
Theo PT (1): nNO= 2/3. nCu= 2/3 (2x+2y)= 0,4 (II)
Giải hệ (I, II) ta có: x= 0,2; y= 0,1
% V C O = % n C O = 0 , 2 0 , 7 . 100 % = 28 , 57 %

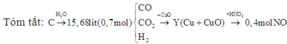
Quan sát – phân tích: Đề yêu cầu là tính phần trăm thể tích của CO. Vậy cái ta cần tìm chính là số mol của CO. Dựa vào sơ đồ ta nghĩ tới lập hệ phương trình 3 ẩn tương ứng với số mol của ba chất. Nhưng từ sơ đồ ta chỉ có thể lập được 2 hệ phương trình vậy thì không thể giải được bằng cách này. Vậy bài tập này sẽ có gì đó đặc biệt hoặc là phải biện luận. Khi viết phương trình phản ứng ra ta thấy:
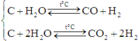
Cả hai phương trình này đều tạo ra H2. Vậy chúng ta chỉ cần gọi 2 ẩn là có thể biểu diễn được số mol của H2 theo hai ẩn đó.
Kết hợp với dữ liệu còn lại ta tìm ngay được đáp án.
Gọi a và b lần lượt là số mol của CO và CO2 ⇒ Số mol của H2 là: n H 2 = a + 2 b
Theo giả thiết ta có: a + b +a + 2b = 0,7 ⇔ 2a + 3b = 0,7 (1)
Ta có: C u + 2 → C u 0 → C u + 2
Vậy ta sẽ bỏ qua bước trung gian là Cu và coi rằng (CO và H2) phản ứng với HNO3 tạo ra sản phẩm khử NO.
Áp dụng định luật bảo toàn electron ta có:

Đáp án C.
Chọn đáp án D
H 2 O + C ® CO + H 2
(mol) x x x x
2 H 2 O + C ® C O 2 + 2 H 2
(mol) 2y y y 2y
3CO + F e 2 O 3 → 3 C O 2 + Fe
(mol) x x 3 x 2 x 3
3 H 2 + F e 2 O 3 → 3 H 2 O + 3Fe
(mol) x + 2y x + 2 y 3 x + 2y 2 x + 2 y 3
Ta có: n F e 2 O 3 = x 3 + x + 2 y 3 = 48 100 = 0 , 3
n H 2 O = x + 2 y = 10 , 8 18 = 0 , 6
Þ x = 0,3; y = 0,15 Þ tổng số mol khí than ướt = 0,3 + 0,15 + 0,6 = 1,05
% V C O 2 = 0 , 15 1 , 05 . 100 % = 14 , 286 %