Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol HCl = 0,016.1,25 = 0,02 mol.
a) Gọi V là thể tích nước cần thêm vào, ta có: 0,25.(V+16) = 0,02 hay V = 64 ml.
b) Sau khi trộn thu được thể tích là 96 ml. Do đó: 0,25.0,096 = 0,02 + 0,08a hay a = 0,05 M.

A(Fe, S) ==nung==> B(Fe, S, FeS) ==HCl==> C(H2, H2S)
B(Fe, S, FeS) ==nung==> (Fe2O3, SO2)
Bằng phương pháp sơ đồ đường chéo bạn dễ dàng tính được tỉ lệ nH2/nH2S = 1/3
Mà nH2 + nH2S = V
=> nH2 = 0,25V và nH2S = 0,75V
Sau khi viết tất cả các phương trình phản ứng, bạn dễ dàng tính được những kết quả sau :
nFe (trong B) = nH2 = 0,25V mol => mFe = 14V g
nFeS (trong B) = nH2S = 0,75V mol => mFeS = 66V g
Phản ứng của B với O2 :
4FeS + 7O2 = 2Fe2O3 + 4SO2
0,75V....1,3125V mol
S + O2 = SO2
x.....x
Ta có 1,3125V + x = V'' => nS = x = V'' - 1,3125V
=> mS = 32V'' - 42V
mB = mFe + mS + mFeS = 14V + 32V'' - 42V + 66V = 38V + 32V'' g
b. nS = V'' - 1,3125V => V'' > 1,3125V => V''/V > 1,3125

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 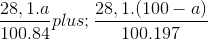 = 0,2
= 0,2
=> a = 29,89.

sử dụng quy tắc đường chéo ( ở đây ko có chức năng nối nên mình ko nối vào cho bạn thấy rõ được)
15% < C% < 30% ( * )
200g dd H2SO4 15% 30% - C%
C%
300g dd H2SO4 30% C% - 15%
200/300 = 2/3 = ( 30 - C ) / ( C - 15 ) <=> 2C - 30= 90 - 3C
<=> 5C = 120
<=> C = 24 (%) ( thỏa mãn * )

TL:
Đốt cháy hh X cũng chính là đốt cháy C4H10 ban đầu.
C4H10 + O2 \(\rightarrow\) 4CO2 + 5H2O
0,1 0,4 0,5 mol
Sản phẩm cháy gồm 0,4 mol CO2 và 0,5 mol H2O. Khi hấp thụ vào nước vôi trong dư thì xảy ra phản ứng sau:
CO2 + Ca(OH)2 \(\rightarrow\) CaCO3 + H2O
0,4 0,4 mol
Như vậy khối lượng hấp thụ vào = 0,4.44 + 0,5.18 = 26,6 g. Khối lượng kết tủa tách ra khỏi dd = 0,4.100 = 40 g.
Do đó, khối lượng dd giảm = 40 - 26,6 = 13,4 g.

Fe được hòa tan hoàn toàn bởi dd HNO3 thu được dd X, khi thêm HCl vào X có khí NO thoát ra → trong X có ion Fe2+ → HNO3 đã phản ứng hết
n(NO) = 1,12/22,4 = 0,05mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 4H2O
0,05___0,2______________0,05
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
x___________________3x
Theo ĐL bảo toàn nguyên tố, số mol NO3- có trong muối:
n(NO3- trong muối) = n(HNO3) - n(NO) = 0,15mol
n(NaOH) = 0,115.2 = 0,23mol
Sau khi NaOH pư hoàn toàn với các chất trong dd Y, dung dịch thu được có:
n(Na+) = n(NaOH) = 0,23mol; n(Cl-) = n(HCl) = 0,1mol
→ n(NO3-) = n(Na+) - n(Cl-) = 0,23 - 0,1 = 0,13mol
→ Số mol NO3- bị Fe2+ khử: 0,15 - 0,13 = 0,02mol
NO3- + 3Fe2+ + 4H+ → 3Fe3+ + NO + 2H2O
0,02___0,06____0,08
NO3- và H+ đều dư (H+ dư 0,02mol) → Fe2+ đã phản ứng hết → 3x = 0,06 → x = 0,02mol
Tổng số mol Fe: n(Fe) = 0,05 + x = 0,07mol
Khối lượng Fe đã sử dụng: m(Fe) = 0,07.56 = 3,92g

Mol \(Fe\) = 0,11 mol
Mol hh khí= 0,1 mol
BT klg\(\Rightarrow\)m hh khí=12,09-6,16=5,93g
Gọi mol \(Cl_2\) và mol \(O_2\) lần lượt là x và y
\(\Rightarrow\) x+y=0,1 và 71x+32y=5,93
\(\Rightarrow\)x=0,07 và y=0,03
Mol \(Cl-\) trong muối= 0,07.2=0,14 mol = mol \(AgCl\)
\(Fe\) có thể lên \(Fe+2\) và \(Fe+3\) nên
\(Fe\Rightarrow Fe^{+2}+2e\)
a mol. \(\Rightarrow\)2a mol
\(Fe\Rightarrow Fe^{+3}+3e\)
b mol \(\Rightarrow\)3b mol
\(Cl_2+2e\Rightarrow2Cl-\)
0,07 \(\Rightarrow\)0,14 mol
\(O_2+4e\Rightarrow2O_2-\)
0,03\(\Rightarrow\)0,12 mol
Mol e nhường= nhận\(\Rightarrow\)2a+3b=0,26 mol và tổng mol \(Fe\)là a+b=0,11 mol\(\Rightarrow\)a=0,07 và b=0,04
\(Fe^{2+}+Ag^+\Rightarrow Fe^{3+}+Ag\)
0,07 mol \(\Rightarrow\)0,07 mol
Số gam kết tủa = 0,07.108+0,14.143,5=27,65\(\Rightarrow\)chọn A
Đáp án b nhé :44,87...lưu ý khi tính ra số mol fe2+ = 0,07, mol fe3+=0,04 thì =>>> mol Cl- = 0,07x2 + 0,04x3= 0,26 mol.....==>> mol AgCl=0,26.......Để ý hòa tan bằng dd Hcl vừa đủ thì oxit phải chuyển thành hết muối clorua....ko đẻ ý điều này rất dễ nhầm đáp án là A...lừa đó ^^
Đáp án C
pH = 12 => pOH = 2 => n O H - b đ = 0 , 01 a
n H + bđ = 8.10-3
pH sau = 11 > 7 => OH-dư
Ta có: pOH sau = 3 => [OH-] dư = 10-3M => n O H - dư = 0,01a – 8.10-3 = 10-3.(a + 8)
=> a = 1,78