Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a) n_{Al} = \dfrac{7,5.36\%}{27} = 0,1(mol)\\ n_{Mg} = \dfrac{7,5-0,1.27}{24} = 0,2(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{AlCl_3} = n_{Al}= 0,1(mol) \Rightarrow m_{AlCl_3} = 0,1.133,5 = 13,35(gam)\\ n_{MgCl_2}= n_{Mg} = 0,2(mol) \Rightarrow m_{MgCl_2} = 0,2.95 = 19(gam)\\ b) n_{H_2} = \dfrac{3}{2}n_{Al} + n_{Mg} = 0,35(mol)\\ V_{H_2} = 0,35.22,4 = 7,84(lít)\)

a) \(n_{Al}=\dfrac{7,5.36\%}{27}=0,1\left(mol\right)\)
\(n_{Mg}=\dfrac{7,5-0,1.27}{24}=0,2\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,1------------>0,1----->0,15
Mg + 2HCl --> MgCl2 + H2
0,2------------>0,2----->0,2
=> mmuối = 0,1.133,5 + 0,2.95 = 32,35 (g)
b) VH2 = (0,15 + 0,2).22,4 = 7,84 (l)

mAl=36%.7,5=2,7(gam)
\(\Rightarrow\)mMg=7,5-2,7=4,8(gam)
PTHH:2Al+6HCl\(\underrightarrow{ }\)3H2+2AlCl3(1)
Mg+2HCl\(\underrightarrow{ }\)H2+MgCl2(2)
Theo PTHH(1):54 gam Al tạo ra 67,2 lít H2 và 267 gam AlCl3
Vậy:2,7 gam Al tạo ra 3,36 lít H2 và 13,35 gam AlCl3
Theo PTHH(2):24 gam Mg tạo ra 22,4 lít H2 và 95 gam MgCl2
Vậy:4,8 gam Mg tạo ra 4,48 lít H2 và 19 gam MgCl2
Vậy \(V_{H_2}=4,48+3,36=7,84\left(lít\right)\)
mkhối lượng hỗn hợp thu được=13,35+19 =32,35(gam)

Lập hệ phương trình ( Al là x , Mg là y )
\(\left\{{}\begin{matrix}27x+24y=15\\27x=\dfrac{36}{100}.15\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
2Al + 6HCl ---> 2AlCl3 + 3H2
0,2 0,3
2Mg + 4HCl ---> 2MgCl2 + 2H2
0,4 0,4
\(\Sigma n_{H2\uparrow}=0,3+0,4=0,7\left(mol\right)\)
\(\Rightarrow V_{H2\uparrow}=0,7.22,4=15,68\left(l\right)\)

a) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) (2)
Theo PT (1): \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Al_2O_3}=15,6-5,4=10,2\left(g\right)\end{matrix}\right.\)
b) \(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
Theo PT (1), (2): \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}+n_{Al_2O_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{mu\text{ố}i}=m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)
c) Theo PT (1), (2): \(n_{H_2SO_4}=n_{H_2}+3n_{Al_2O_3}=0,6\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(c\text{ần}.d\text{ùng}\right)}=0,6.98=58,8\left(g\right)\)

a)
Có \(\left\{{}\begin{matrix}\dfrac{m_{Mg}}{m_{Fe}}=\dfrac{2}{3}\\m_{Mg}+m_{Fe}=8,4\end{matrix}\right.=>\left\{{}\begin{matrix}m_{Mg}=3,36\left(g\right)\\m_{Fe}=5,04\left(g\right)\end{matrix}\right.\)
b)
\(\left\{{}\begin{matrix}n_{Mg}=\dfrac{3,36}{24}=0,14\left(mol\right)\\n_{Fe}=\dfrac{5,04}{56}=0,09\left(mol\right)\end{matrix}\right.\)
PTHH: Mg + 2HCl --> MgCl2 + H2
_____0,14-------------------->0,14
Fe + 2HCl --> FeCl2 + H2
0,09-------------------->0,09
=> nH2 = 0,23(mol)
=> VH2 = 0,23.22,4 = 5,152(l)
c)
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ \(\dfrac{0,2}{1}< \dfrac{0,23}{1}\) => CuO hết, H2 dư
PTHH: CuO + H2 --to--> Cu + H2O
_______0,2-------------->0,2
=> mCu = 0,2.64 = 12,8 (g)
nots em câu này với ạ
Câu 6: Hòa tan hoàn toàn 13 gam một kim loại R hóa trị II bằng dd H2SO4. Sau phản ứng, cô cạn dung dịch được
32,2 gam muối khan và V lit khí hidro (đktc). Hãy xác định tên và KHHH của kim loại R. Tính V.

\(n_{Mg}=a;n_{Fe}=0,5a;n_{Zn}=b\\ a\left(24+28\right)+65b=52a+65b=44,2\\ 1,5a+b=\dfrac{24,64}{22,4}1,1\\ a=0,6;b=0,2\\ \%m_{Mg}=\dfrac{24a}{44,2}=32,58\%\\ \%m_{Fe}=\dfrac{28a}{44,2}=38\%\\ \%m_{Zn}=29,42\%\\ m_{ddacid}=\dfrac{98\left(1,5a+b\right)}{0,08}=1347,5g\\ m_{ddsau}=1389,5g\\ C\%_{MgCl_2}=\dfrac{95a}{1389,5}=4,10\%\\ C\%_{FeCl_2}=\dfrac{127.0,5a}{1389,5}=2,74\%\\ C\%_{ZnCl_2}=\dfrac{136b}{1389,5}=1,96\%\)

Bài 1:
\(n_{H_2SO_4}=\dfrac{300.19,6\%}{98}=0,6\left(mol\right);n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\\ PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Vì:\dfrac{0,1}{2}< \dfrac{0,6}{3}\Rightarrow H_2SO_4dư\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{3n_{Al}}{2}=\dfrac{3.0,1}{2}=0,15\left(mol\right)\\ a,m_{Al_2\left(SO_4\right)_3}=342.0,15=51,3\left(g\right)\\ b,m_{ddsau}=m_{Al}+m_{ddH_2SO_4}-m_{H_2}=2,7+300-\dfrac{3}{2}.0,1.2=302,4\left(g\right)\\ c,C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{51,3}{302,4}.100\%\approx16,964\%\\ n_{H_2SO_4\left(dư\right)}=0,6-\dfrac{3}{2}.0,1=0,45\left(mol\right)\\ C\%_{ddH_2SO_4\left(dư\right)}=\dfrac{0,45.98}{302,4}.100\%\approx14,583\%\)
Bài 2:
\(PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ Đặt:n_{Al}=a\left(mol\right);n_{Mg}=b\left(mol\right)\left(a,b>0\right)\\ Hpt:\left\{{}\begin{matrix}27a+24b=7,8\\1,5a+b=\dfrac{8,96}{22,4}=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\\ \%m_{Al}=\dfrac{0,2.27}{7,8}.100\%\approx69,231\%\Rightarrow\%m_{Mg}\approx100\%-69,231\%\approx30,769\%\)

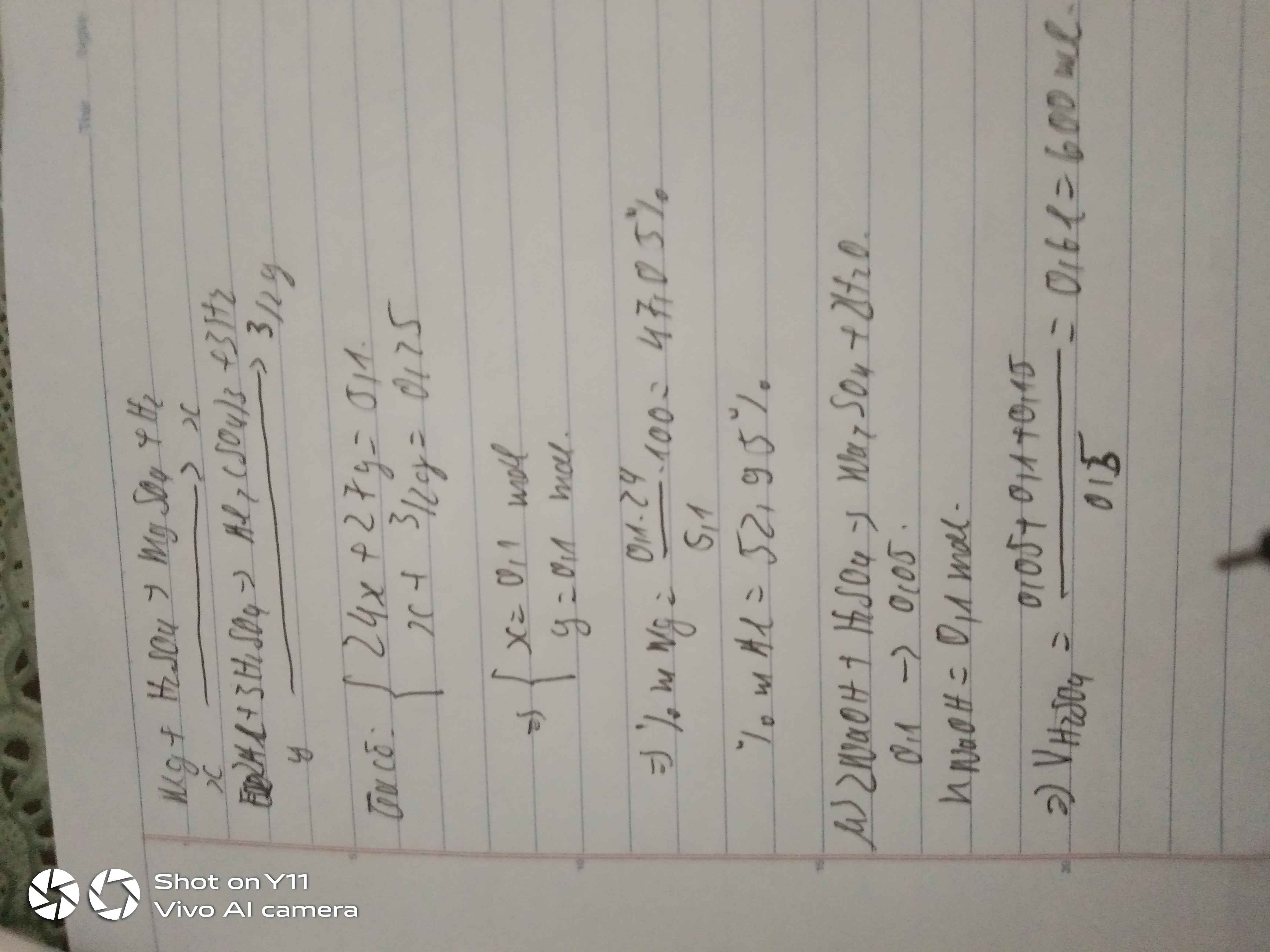
mAl=36%.7,5=2,7(gam)
⇒⇒mMg=7,5-2,7=4,8(gam)
PTHH:2Al+6HCl→→3H2+2AlCl3(1)
Mg+2HCl→→H2+MgCl2(2)
Theo PTHH(1):54 gam Al tạo ra 67,2 lít H2 và 267 gam AlCl3
Vậy:2,7 gam Al tạo ra 3,36 lít H2 và 13,35 gam AlCl3
Theo PTHH(2):24 gam Mg tạo ra 22,4 lít H2 và 95 gam MgCl2
Vậy:4,8 gam Mg tạo ra 4,48 lít H2 và 19 gam MgCl2
Vậy VH2=4,48+3,36=7,84(lít)
mkhối lượng hỗn hợp thu được=13,35+19 =32,35(gam)