
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

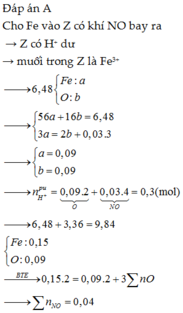


Đáp án C
Fe + ddZ → khí NO => X chứa H N O 3 dư. Quy X về Fe và O
Trong X, đặt ![]()
Bảo toàn electron:
![]()
Giải hệ có: x = 0,12 mol; y = 0,09 mol
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
![]()
![]()
![]()

Quy hỗn hợp về Fe và O với số mol lần lượt là a;b
$\Rightarrow 56a+16b=8,16$
Bảo toàn e ta được $3a-2b=0,06.3$
Giải hệ ta được $a=0,12;b=0,09$
Bảo toàn e cho phản ứng (2) ta có: $n_{NO}=0,02(mol)\Rightarrow n_{H^+/du}=0,08(mol)$
Dùng phương trình $H^+$ suy ra $n_{HNO_3}=0,5(mol)$
Coi hỗn hợp X gồm : Fe , O
\(n_{Fe}=a\left(mol\right),n_O=b\left(mol\right)\)
\(m_X=56a+16b=8.16\left(g\right)\left(1\right)\)
\(n_{NO}=\dfrac{1.344}{22.4}=0.06\left(mol\right)\)
\(\text{Bảo toàn e : }\)
\(3a=2b+3\cdot0.06\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.12,b=0.09\)
\(\text{Bảo toàn e cho cả quá trình : }\)
\(2n_{Fe}=3n_{NO\left(1\right)}+2n_{NO\left(2\right)}\)
\(\Rightarrow n_{NO\left(2\right)}=0.08\)
\(n_{HNO_3}=0.5\left(mol\right)\)

Quy hỗn hợp về Fe và O với số mol lần lượt là a;b(mol)
$\Rightarrow 56a+16b=8,16$
Bảo toàn e ta được $3a-2b=0,06.3$
Giải hệ ta được $a=0,12'b=0,09$
Bảo toàn e cho phản ứng (2) ta có:
$n_{NO}=0,02(mol)\Rightarrow n_{H^+/dư}=0,08(mol)$
Dùng phương trình $H^+$ suy ra $n_{HNO_3}=0,5(mol)$