Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
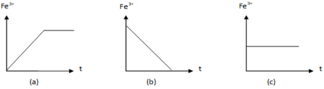
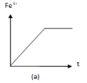
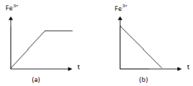
- Đồ thị (a) cho thấy lượng Fe3+ từ 0 tăng dần sau đó không đổi nên ứng với thí nghiệm (1).
+ Phương trình phản ứng ![]()
+ Phương trình phản ứng : ![]()
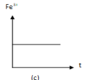
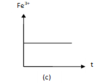
- Đồ thị (c) cho thấy lượng Fe3+ không đổi nên ứng với phản ứng (3).
+ Phương trình phản ứng : ![]()

Chọn A
Các mệnh đề d, e.
+ TN a: tạo phức [Ag(NH3)2]OH.
+ TN b: Không có phản ứng.
+ TN c: Ba + 2H2O → Ba(OH)2 + H2. Sau đó: 2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2.
→ tỉ lệ 1:1 nên Ba(OH)2 dư
+ TN d: NaAlO2(dư) + HCl + H2O → Al(OH)3 + NaCl
+ TN e: Cu + 2FeCl3 → 2FeCl2 + CuCl2.
Tỉ lệ 1:1 → FeCl3 dư.
+ TN f: 2FeBr2 + K2Cr2O7 + 7H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 2Br2 + 7H2O.
+ TN g: không tác dụng
+ TN h:
9Fe(NO3)2 + 12HCl → 3NO + 5Fe(NO3)3 + 4FeCl3 + 6H2O.
9------------------------------------------5------------4
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O.
22,5 ←15
2Fe3+ + Cu → 2Fe2+ + Cu2+.
9← 4,5
Tỉ lệ mol 1:3 → Cu hết, không tạo thêm chất rắn nào.
+ TN i: Na2S và CaCl2: không tác dụng.
+ TN j: 1 mol Al + 1 mol Zn tác dụng vừa đủ với 3 mol NaOH→ không tạo ra chất rắn, cũng không có rắn dư

Đáp án C
Các mệnh đề d, e.
+ TN a: tạo phức [Ag(NH3)2]OH.
+ TN b: Không có phản ứng.
+ TN c: Ba + 2H2O → Ba(OH)2 + H2. Sau đó: 2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2.
→ tỉ lệ 1:1 nên Ba(OH)2 dư
+ TN d: NaAlO2(dư) + HCl + H2O → Al(OH)3 + NaCl
+ TN e: Cu + 2FeCl3 → 2FeCl2 + CuCl2.
Tỉ lệ 1:1 → FeCl3 dư.
+ TN f: 2FeBr2 + K2Cr2O7 + 7H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 2Br2 + 7H2O.
+ TN g: không tác dụng
+ TN h:
9Fe(NO3)2 + 12HCl → 3NO + 5Fe(NO3)3 + 4FeCl3 + 6H2O.
9 → 5 → 4
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O.
22,5 ←15
2Fe3+ + Cu → 2Fe2+ + Cu2+.
9← 4,5
Tỉ lệ mol 1:3 → Cu hết, không tạo thêm chất rắn nào.
+ TN i: Na2S và CaCl2: không tác dụng.
+ TN j: 1 mol Al + 1 mol Zn tác dụng vừa đủ với 3 mol NaOH → không tạo ra chất rắn, cũng không có rắn dư

Chọn A
Các mệnh đề d, e.
+ TN a: tạo phức [Ag(NH3)2]OH.
+ TN b: Không có phản ứng.
+ TN c: Ba + 2H2O → Ba(OH)2 + H2. Sau đó: 2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2.
→ tỉ lệ 1:1 nên Ba(OH)2 dư
+ TN d: NaAlO2(dư) + HCl + H2O → Al(OH)3 + NaCl
+ TN e: Cu + 2FeCl3 → 2FeCl2 + CuCl2.
Tỉ lệ 1:1 → FeCl3 dư.
+ TN f: 2FeBr2 + K2Cr2O7 + 7H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 2Br2 + 7H2O.
+ TN g: không tác dụng
+ TN h:
9Fe(NO3)2 + 12HCl → 3NO + 5Fe(NO3)3 + 4FeCl3 + 6H2O.
9------------------------------------------5------------4
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O.
22,5 ←15
2Fe3+ + Cu → 2Fe2+ + Cu2+.
9← 4,5
Tỉ lệ mol 1:3 → Cu hết, không tạo thêm chất rắn nào.
+ TN i: Na2S và CaCl2: không tác dụng.
+ TN j: 1 mol Al + 1 mol Zn tác dụng vừa đủ với 3 mol NaOH→ không tạo ra chất rắn, cũng không có rắn dư

Đáp án C
TN1: Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2.
TH2: CO2 dư + NaOH → NaHCO3.
TH3: Na2CO3 + Ca(HCO3)2 → CaCO3 + 2NaHCO3.
TH4: Fe + 2FeCl3 → 3FeCl2.
TH5: Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O.
Fe (dư) + 2Fe(NO3)3 → 3Fe(NO3)2.
TH6: 4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O.

Đáp án A
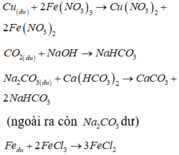
Vậy có 2 thí nghiệm dung dịch thu được chỉ chứa 1 muối tan là (b), (d).

Đáp án A
+ Đồ thị (a) cho thấy lượng Fe3+ từ 0 tăng dần sau đó không đổi nên ứng với thí nghiệm (1). Phương trình phản ứng:
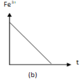
+ Đồ thị (b) cho thấy lượng Fe3+ giảm dần về 0 nên ứng với phản ứng (2). Phương trình phản ứng:
+ Đồ thị (c) cho thấy lượng Fe3+ không đổi nên ứng với phản ứng (3). Phương trình phản ứng: