Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al}=\dfrac{10,8}{27}=0,4mol\)
\(n_{HCl}=\dfrac{49}{36,5}=1,34mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Xét: \(\dfrac{0,4}{2}\) < \(\dfrac{1,34}{6}\) ( mol )
0,4 1,2 0,4 0,6 ( mol )
\(V_{H_2}=0,6.22,4=13,44l\)
\(m_{AlCl_3}=0,4.133,5=53,4g\)
\(m_{HCl\left(dư\right)}=\left(1,34-1,2\right).36,5=5,11g\)
Nhúng quỳ tím vào dung dịch sau phản ứng thấy quỳ tím hóa đỏ, vì sau phản ứng dd HCl còn dư.

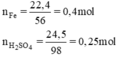
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 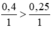 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe.dư\\ n_{H_2}=n_{H_2SO_4}=n_{Fe\left(p.ứ\right)}=0,25\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\\ m_{Fe\left(dư\right)}=0,15.56=8,4\left(g\right)\)

a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)

a, \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Xét tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,25}{1}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=n_{H_2SO_4}=0,25\left(mol\right)\Rightarrow n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe\left(dư\right)}=0,15.56=8,4\left(g\right)\)
b, \(n_{H_2}=n_{H_2SO_4}=0,25\left(mol\right)\Rightarrow V_{H_2}=0,25.22,4=5,6\left(l\right)\)

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe.dư\\ n_{H_2}=n_{Fe\left(p.ứ\right)}=n_{H_2SO_4}=0,25\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(g\right)\\ m_{Fe\left(dư\right)}=0,14.56=8,4\left(g\right)\)

PTHH: \(Fe+H_2SO_{4\left(l\right)}\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Sắt còn dư, Axit p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,25\left(mol\right)\\n_{Fe\left(dư\right)}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,25\cdot22,4=5,6\left(l\right)\\m_{Fe\left(dư\right)}=0,15\cdot56=8,4\left(g\right)\end{matrix}\right.\)

\(a,2Na+2H_2O\rightarrow2NaOH+H_2\\ 2K+2H_2O\rightarrow2KOH+H_2\\ b,n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right);n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\\ n_{H_2}=\dfrac{1}{2}.\left(0,2+0,1\right)=0,15\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\\ c,Dung.dịch.sau.phản.ứng.có.KOH.và.NaOH.đều.là.kiềm.\\ \Rightarrow Quỳ.tím.hoá.xanh\)
\(n_{Na}=\dfrac{m}{M}=\dfrac{4,6}{23}=0,2mol\)
\(n_K=\dfrac{m}{M}=\dfrac{3,9}{39}=0,1mol\)
\(Na+2H_2O\rightarrow Na\left(OH\right)_2+H_2\)
\(K+2H_2O\rightarrow K\left(OH\right)_2+H_2\)
\(V_{H_2}=n_{H_2}.22,4=\left(0,2+0,1\right).22,4=6,72l\)
Dung dịch sau phản ứng làm quỳ tím chuyển sang màu xanh
a) \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\); \(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{0,5}{1}\) => Fe hết, H2SO4 dư
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,4--->0,4-------->0,4--->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)
b) Do trong dd sau pư có H2SO4 dư nên dd làm quỳ tím chuyển màu đỏ
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\ n_{H_2SO_{\text{ 4 }}}=\dfrac{49}{98}=0,5\left(mol\right)\\ pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
LTL: 0,4<0,5 => Fe hết H2SO4 dư
theo pthh : nH2 = nFe =0,4(mol)
=> \(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
dd là muối => nhưng có H2SO4 dư nên qt CHUYỂN đỏa