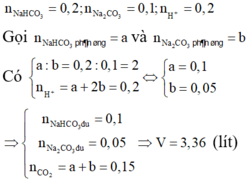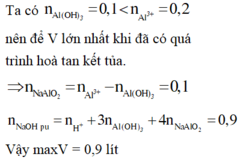Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{OH^-}=0,2.1+0,2.1.2=0,6\left(mol\right)\)
\(n_{H^+}=V.2+V.1.2=4V\left(mol\right)\)
H+ + OH- --------> H2O (1)
Vì dung dịch A được trung hòa bởi 200 ml dd HNO3 1M
=>Dung dịch A có OH- dư sau phản ứng
\(n_{H^+}=0,2.1=0,2\left(mol\right)\)
H+ + OH- dư --------> H2O
=> \(n_{OH^-\left(dư\right)}=n_{H^+\left(củaHNO3\right)}=0,2\left(mol\right)\)
=> \(n_{OH^-\left(pứ\right)}=0,6-0,2=0,4\left(mol\right)\)
Từ (1) => \(n_{H^+}=n_{OH^-\left(pứ\right)}=0,4\left(mol\right)\)
=> 4V=0,4
=> V= 0,1 (lít)

Đáp án A
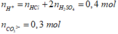
Cho từ từ H+ vào CO32- nên thứ tự phản ứng như sau:
H+ + CO32- →HCO3-
0,3←0,3→ 0,3
H+ + HCO3- → H2O + CO2
0,1→0,1 → 0,1
V=0,1.22,4=2,24 lít

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)

Đáp án A
Dd C có: nHCO3-= 0,2 mol ; nCO32-= 0,2 mol.
Dd D:nH+= 0,3 mol ;
Nhỏ từ từ D vào C
CO32- + H+ → HCO3-
0,2 → 0,2 → 0,2
=> nH+ = 0,1 mol ; mol
Cho Ba(OH)2 vào E
HCO3- + H+ → H2O + CO2
0,1 → 0,1 → 0,1
=>VCO2= 0,1.22,4 = 2,24 lít.
Ba2+ + HCO3- + OH- → BaCO3 + H2O
0,3 → 0,3
Ba2+ + SO42- → BaSO4
0,1 → 0,1
=> m = 0,3.197 + 0,1.233 = 82,4 gam.