Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
nH2SO4 = 0,49 mol > nH2 = 0,25 mol => axit dư
=> Fe ; Al hết. Chất rắn là Cu
=> mFe + mAl = 56nFe + 27nAl = 17,9 – 9,6 = 8,3g
nH2 = nFe + 1,5nAl = 0,25 mol
=> nFe = nAl = 0,1 mol.
nH2SO4 dư = 0,49 – 0,25 = 0,24 mol => nH+ = 0,48 mol
Khi thêm 0,12 mol NaNO3 vào thì Cu( 0,15 mol) và Fe2+ phản ứng
3Cu + 8H+ + 2NO3- -> 3Cu2+ + 2NO + 4H2O
0,15->0,4 -> 0,1 mol
3Fe2+ + 4H+ + NO3- -> 3Fe3+ + NO + 2H2O
0,06<- 0,08 -> 0,02
=> VNO = 0,12.22,4 = 2,688 lit
Vậy trong dung dịch sau có : 0,06 mol Fe3+ ; 0,04 mol Fe2+ ; 0,15 mol Cu2+ ; 0,1 mol Al3+ ; 0,49 mol SO42-; 0,12 mol Na+
=> m = 67,7g

Đáp án D
Sau phản ứng của H2SO4 với các kim loại thì còn 0,32 gam rắn. Thêm NaNO3 vào lại có khi
=> H+ dư sau phản ứng đầu tiên
=> Fe, Al đã phản ứng hết.
Do đó 0,32 gam chính là Cu.
nNaNO3 = 0,005 mol


Đáp án : C
nH+ = 2nH2SO4 + nHCl = 0,42 mol
, nH2 = 0,17 mol => nH+ dư = 0,08 mol
Trong dung dịch chắc chắn có Al3+ và Fe2+ với số mol lần lượt là x và y
=> mAl + mFe = 27x + 56y = 7,52 – 2,56 = 4,96g
Lại có : 3nAl + 2nFe = 2nH2 (Bảo toàn e) => 3x + 2y = 0,34
=> x = 0,08 ; y = 0,05 mol
, nNaNO3 = 0,02 mol
Khi cho NaNO3 vào thì xảy ra phản ứng với Cu trước Fe2+
3Cu + 8H+ + 2NO3- à 3Cu2+ + 2NO + 4H2O
=> Cu dư và trong muối có : 0,03 mol Cu2+ ; 0,02 mol Na+ ; 0,08 mol Al3+ ; 0,05 mol Fe2+ ; 0,18 mol SO42- ; 0,06 mol Cl-
=> mmuối = 26,75g và VNO = 0,448 lit

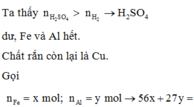
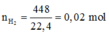

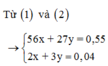
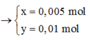

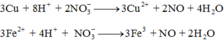

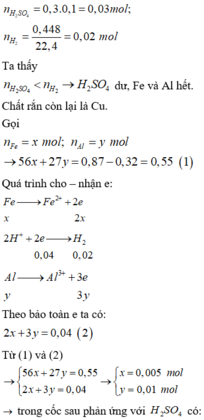

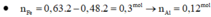
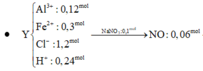
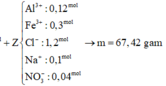
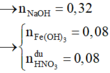
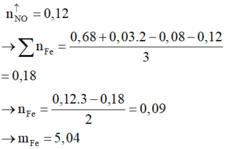


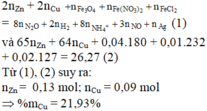
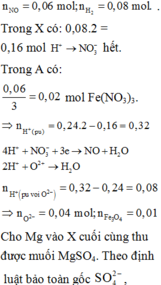
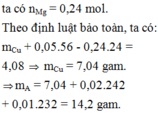
Đáp án : B
Vì Cu không phản ứng với H2SO4 loãng => mCu = 9,6g => nCu = 0,15 mol
,nH2 = 0,25 mol < nH2SO4 = 0,5 mol
=> axit dư nH+ = 0,5 mol và kim loại tan hết
=> 3nAl + 2nFe = 2nH2 = 0,5 mol và 27nAl + 56nFe = 17,9 – 9,6
=> nAl = nFe = 0,1 mol
,nNaNO3 = 0,12 mol
3Cu + 8H+ + 2NO3- -> 3Cu2+ + 2NO + 4H2O
3Fe2+ + 4H+ + NO3- -> 3Fe3+ + NO + 2H2O
=> sau phản ứng có : 0,15 mol Cu2+ ; 0,1 mol Al3+ ; 0,1 mol Fex+ ; 0,5 mol SO42- ; 0,12 mol Na+ ; 0,02 mol H+
,nNO = nNO3 = 0,12 mol => V = 2,688 lit
Nếu tính lượng muối thì phải loại ra 0,01 mol H2SO4
=> mmuối = 67,7g