Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
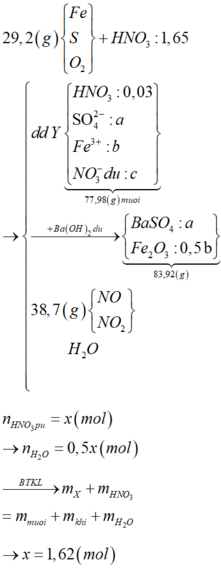
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
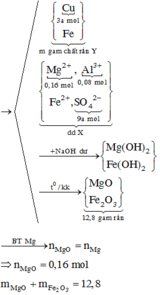
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%



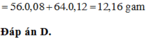

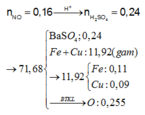
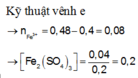
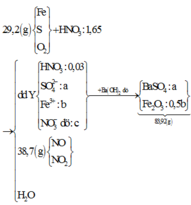
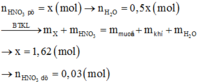
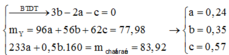
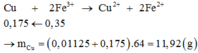
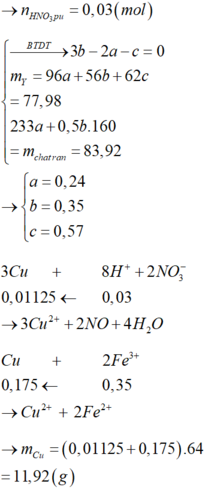
Đáp án C
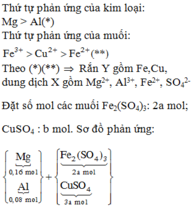
Chất rắn Y gồm 2 kim loại là Cu và Fe.
Hòa tan hết Y trong HNO3 đặc nóng thu được 0,115 mol NO2.
Gọi số mol Cu và Fe trong Y lần lượt là a, b.