Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tóm tắt quá trình phản ứng:
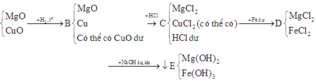
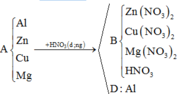
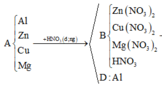
Toàn bộ các phản ứng có thể xảy ra:
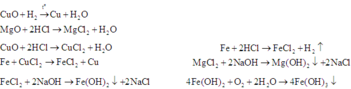
* Đầu tiên, ta xét xem trong hỗn hợp B có CuO dư hay không.
n H C l b a n đ ầ u = 0 , 6 ; n H C l p h ả n ứ n g v ớ i F e = 2 n H 2 ⇒ n H C l p h ả n ứ n g v ớ i B = 0,6 - 0,1 = 0,5
Nếu B không có CuO dư, khi đó trong B chi có MgO phản ứng với HCl.
Khi đó m M g O = 1 2 n H C l p h ả n ứ n g v ớ i B = 0 , 25 ⇒ m M g O = 10 ( g a m )
Mặt khác n C u ( B ) = n H 2 O = 0 , 06
Nếu B không có CuO, tức là CuO trong hỗn hợp ban đầu bị khử hết thì nCuO = nCu = 0,06
![]()
Vậy trong hỗn hợp B có CuO dư.
* Sau khi xác định chính xác thành phần của các hỗn hợp, chúng ta bắt đầu tính toán theo yêu cầu đề bài.
Hỗn hợp B có m M g O + m C u O = m B - m C u = ( m B + m O g i ả m ) - ( m C u + m O g i ả m ) = m b a n đ ầ u - m C u O b ị H 2 k h ử = 16 ( g a m )

Đáp án C.

Đáp án A
Các phản ứng có thể xảy ra:
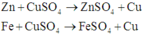
Trong 3 kim loại Zn, Fe và Cu thì Fe có khối lượng mol nhỏ nhất
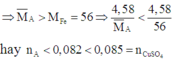
Do đó B chứa Cu2+ dư
Khi đó C chứa Cu trong A và Cu sinh ra sau phản ứng. Nên D chứa CuO.
B chứa Zn2+, Fe2+ và Cu2+ dư. Khi cho B tác dụng với dung dịch NaOH dư thì kết tủa thu được chứa Fe(OH)2 và Cu(OH)2 .
Do đó E chứa Fe2O3 và CuO.
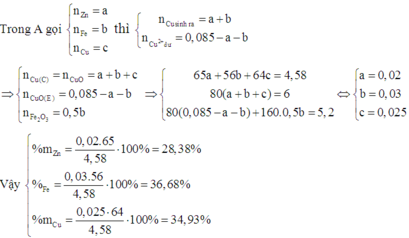

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
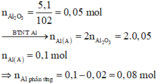
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
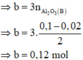
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
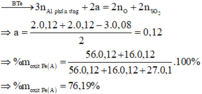

Đáp án D
Dung dịch B mất màu hoàn toàn => Cu2+ phản ứng hết
3 kim loại là Ag, Cu, Fe dư.
mFe dư =55,2-108.0,4-64.0,1=5,6 gam
Đặt số mol Mg và Fe phản ứng lần lượt là x, y
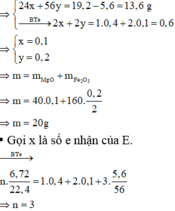
=> Khí E là NO

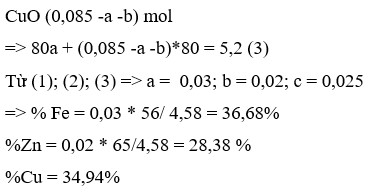
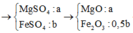
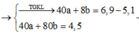
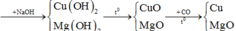
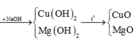
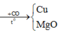
n Cu = 15,04/64 = 0,235(mol)
n Cu dư = 2,24/64 = 0,035(mol)
=> n Cu pư = 0,235-0,035 = 0,2(mol)
$Cu + Fe_2(SO_4)_3 \to 2FeSO_4 + CuSO_4$
n FeSO4 = 0,2.2 = 0,4(mol)
n CuSO4 = 0,2(mol)
Chất rắn A : Cu dư
Dung dịch B : FeSO4,CuSO4
D : CuS
E : FeSO_4,H2SO4
$CuSO_4 + H_2S \to CuS + H_2SO_4$
n CuS = n H2SO4 = n CuSO4 = 0,2(mol)
m D = 0,2.96 = 19,2(gam)
$Cu + H_2SO_4 + \dfrac{1}{2}O_2 \to CuSO_4 + H_2O$
n Cu = 0,035 < n H2SO4 = 0,2 nên H2SO4 dư
n CuSO4 = n Cu = 0,035(mol)
n H2SO4 = 0,2 - 0,035 = 0,165(mol)
Vậy dung dịch sau cùng có :
CuSO4 : 0,035(mol)
H2SO4 : 0,165(mol)
FeSO4 = 0,4(mol)
số gam D là bnh ạ????