Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sửa: $V_{H_2}=7,168(l)$
$a\bigg)$
Đặt $n_{Mg}=x;n_{Fe}=y;n_{Al}=z$
$\to 24x+56y+27z=9,52(1)$
$n_{H_2}=\dfrac{7,168}{22,4}=0,32(mol)$
$n_{Cl_2}=\dfrac{8,064}{22,4}=0,36(mol)$
BTe: $x+y+1,5z=n_{H_2}=0,32(2)$
BTe: $x+1,5y+1,5z=n_{Cl_2}=0,36(3)$
Từ $(1)(2)(3)\to x=0,12(mol);y=0,08(mol);z=0,08(mol)$
$\to \begin{cases} \%m_{Mg}=\dfrac{0,12.24}{9,52}.100\%=30,25\%\\ \%m_{Fe}=\dfrac{0,08.56}{9,52}.100\%=47,06\%\\ \%m_{Al}=100-47,06-30,25=22,69\% \end{cases}$
$b\bigg)$
Bảo toàn H: $n_{HCl}=2n_{H_2}=0,64(mol)$
$\to C_{M_{HCl}}=\dfrac{0,64}{0,2}=3,2M$
$\to a=3,2$
$c\bigg)$
Dung dịch sau gồm $MgCl_2,FeCl_2,AlCl_3$
Bảo toàn $Mg,Al,Fe:n_{MgCl_2}=0,12(mol);n_{AlCl_3}=n_{FeCl_2}=0,08(mol)$
$\to C_{M_{MgCl_2}}=\dfrac{0,12}{0,2}=0,6M$
$\to C_{M_{AlCl_3}}=C_{M_{FeCl_2}}=\dfrac{0,08}{0,2}=0,4M$
$a\bigg)$
Đặt $n_{Mg}=x;n_{Fe}=y;n_{Al}=z$
$\to 24x+56y+27z=9,52(1)$
$n_{H_2}=\dfrac{14,336}{22,4}=0,64(mol)$
$n_{Cl_2}=\dfrac{8,064}{22,4}=0,36(mol)$
BTe: $x+y+1,5z=n_{H_2}=0,64(2)$
BTe: $x+1,5y+1,5z=n_{Cl_2}=0,36(3)$
Từ $(1)(2)(3)\to$ nghiệm âm, xem lại đề

Câu 1 :
\(n_{H2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
a 0,15 1,5a
\(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
b 0,3 1b
a) Gọi a là số mol của Al
b là số mol của Zn
\(m_{Al}+m_{Zn}=11,1\left(g\right)\)
⇒ \(n_{Al}.M_{Al}+n_{Zn}.M_{Zn}=11,1g\)
⇒ 27a + 65b = 11,1g(1)
Theo phương trình : 1,5a + 1b = 0,225(2)
Từ(1),(2), ta có hệ phương trình :
27a + 65b = 11,1g
1,5a + 1b = 0,225
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,15\end{matrix}\right.\)
\(m_{Al}=0,05.27=1,35\left(g\right)\)
\(m_{Zn}=0,15.65=9,75\left(g\right)\)
0/0Al = \(\dfrac{1,35.100}{11,1}=12,16\)0/0
0/0Zn = \(\dfrac{9,75.100}{11,1}=87,84\)0/0
b) \(n_{HCl\left(tổng\right)}=0,15+0,3=0,45\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0,45}{1}=0,45\left(l\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_{H2}=\dfrac{1,456}{22,4}=0,065\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
a 0,1 1a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
b 0,03 1,5b
a) Gọi a là số mol của Fe
b là số mol của Al
\(m_{Fe}+m_{Al}=3,07\left(g\right)\)
⇒ \(n_{Fe}.M_{Fe}+n_{Al}.M_{Al}=3,07g\)
⇒ 56a + 27b = 3,07g(1)
Theo phương trình : 1a + 1,5b = 0,065(2)
Từ(1),(2),ta có hệ phương trình :
56a + 27b = 3,07g
1a + 1,5b = 0,065
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,01\end{matrix}\right.\)
\(m_{Fe}=0,05.56=2,8\left(g\right)\)
\(m_{Al}=0,01.27=0,27\left(g\right)\)
0/0Fe = \(\dfrac{2,8.100}{3,07}=91,21\)0/0
0/0Al = \(\dfrac{0,27.100}{3,07}=8,79\)0/0
b) \(n_{HCl\left(tổng\right)}=0,1+0,03=0,13\left(mol\right)\)
\(m_{HCl}=0,13.36,5=4,745\left(g\right)\)
\(m_{ddHCl}=\dfrac{4,745.100}{10}=47.45\left(g\right)\)
Chúc bạn học tốt

Gọi số mol Mg, Fe, Al là a, b, c
=> 24a + 56b + 27c = 23,8
PTHH: Mg + 2HCl --> MgCl2 + H2
a------------------------->a
Fe + 2HCl --> FeCl2 + H2
b------------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
c------------------------->1,5c
=> a + b + 1,5c = \(\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
a-->a
2Fe + 3Cl2 --to--> 2FeCl3
b--->1,5b
2Al + 3Cl2 --to--> 2AlCl3
c--->1,5c
=> \(a+1,5b+1,5c=\dfrac{20,16}{22,4}=0,9\left(mol\right)\)
=> a = 0,3; b = 0,2; c = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)

\(n_{Cl_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_{H_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(n_{H_2}=a+1.5b=0.5\left(mol\right)\)
\(n_{Cl_2}=1.5a+1.5b=0.6\left(mol\right)\)
\(\Rightarrow a=b=0.2\)
\(m_X=0.2\cdot\left(56+27\right)=16.6\left(g\right)\)

1)
- Xét phần 1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,2<-------------------0,2
=> nFe = 0,2 (mol)
- Xét phần 2:
\(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2-->0,6-------->0,1--------->0,3
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,3<----0,6<------0,3<-----0,3
=> nCu = 0,3 (mol)
m = 2.(0,2.56 + 0,3.64) = 60,8 (g)
2)
\(m_{H_2SO_4\left(bđ\right)}=\dfrac{200.98}{100}=196\left(g\right)\)
=> \(m_{H_2SO_4\left(sau.pư\right)}=196-98\left(0,6+0,6\right)=78,4\left(g\right)\)
mdd sau pư = \(\dfrac{60,8}{2}+200-0,6.64=192\left(g\right)\)
\(\left\{{}\begin{matrix}C\%_{\left(Fe_2\left(SO_4\right)_3\right)}=\dfrac{0,1.400}{192}.100\%=20,83\%\\C\%_{\left(CuSO_4\right)}=\dfrac{0,3.160}{192}.100\%=25\%\\C\%_{\left(H_2SO_4.dư\right)}=\dfrac{78,4}{192}.100\%=40,83\%\end{matrix}\right.\)

Fe+2HCl->FeCl2+H2
x---2x-----------x
Mg+2HCl->MgCl2+H2
y------2y-----------y
Ta có :
\(\left\{{}\begin{matrix}56x+24y=24\\x+y=\dfrac{13,44}{22,4}\end{matrix}\right.\)
=>x=0,3 mol, y=0,3 mol
=>%m Fe=\(\dfrac{0,3.56}{24}.100\)=70%
=>%m Mg=100-70=30%
=>VHCl=\(\dfrac{0,3.2+0,3.2}{2}\)=0,6l=600ml
b)
XCl2+2AgNO3->2AgCl+X(NO3)2
0,6--------------------1,2mol
=>m AgCl=1,2.143,5=172,2g

Đáp án A
Tương tự Câu 12, áp dụng định luật bảo toàn mol electron ta có
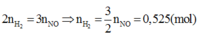
Vậy V= 11,76 (lít)
6,72 hay 6,12 :) ?
6,12 em:>