Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

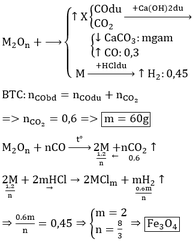
Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.

a)Mg+2CH3COOH→Mg(CH3COO)2+H2
Zn+2CH3COOH→Zn(CH3COO)2+H2
nH2=0,3mol
Gọi a và b lần lượt là số mol của Mg và Zn
\(\left\{{}\begin{matrix}24a+65b=11,3\\a+b=0,3\end{matrix}\right.\)
→a=0,2,b=0,1
→mMg=0,2×24=4,8g
→mZn=0,1×65=6,5g
b)%mMg=\(\dfrac{4,8}{11,3}\)×100%=42,48%
%mZn=\(\dfrac{6,5}{11,3}\)×100%=57,52%
c)nCH3COOH=2nMg+2nZn=0,6mol
→mCH3COOH=0,6×60=36g
→C%CH3COOH=\(\dfrac{36}{200}\)×100%=18%
→nMg(CH3COO)2=nMg=0,2mol
→nZn(CH3COO)2=nZn=0,1mol
→mMg(CH3COO)2=0,2×142=28,4g
→mZn(CH3COO)2=0,1×183=18,3g
nH2=nMg+nZn=0,3mol
→mH2=0,6g
→mddmuối=mhỗnhợp+mddCH3COOH−mH2
→mddmuối=11,3+200−0,6=210,7g
→C%Mg(CH3COO)2=\(\dfrac{28,4}{210,7}\)×100%=13,48%
→C%Zn(CH3COO)2=\(\dfrac{18,3}{210,7}\)×100%=8,69%

vì 3 chất trên đều tác dụng với HCl hóa trị II nên gọi M là nguyên tổ kim loại trung bình của hỗn hợp
ta có: M+2HCl−−>MCl2+H2
theo PT trên ta thấy: nHCl=2nH2=2∗(6.72/22.4)=0.6mol
áp dụng định luật bảo toàn khối lượng ta có
m muối tạo thành = m hỗn hợp + mHCl - mH2 = 14.7 + 0.6*36.5 - 0.3*2 =36 (g)

Bài 4:
a) nH2= 6,72/22,4= 0,3(mol)
Đặt:nMg= x(mol); nZn=y(mol) (x,y>0)
PTHH: Mg + 2 HCl -> MgCl2 + H2
x_______2x________x_____x(mol)
Zn + 2 HCl -> ZnCl2 + H2
y____2y____y________y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24x+65y=15,4\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
mMg=0,1.24=2,4(g)
=>%mMg = (2,4/15,4).100=15,584%
=>%mZn= 84,416%
b) nHCl(tổng)= 0,6(mol)
=> VddHCl=0,6/1=0,6(l)
Chúc em học tốt!

Mg + HCl = MgCl2 + H2
a a
Fe + HCl = FeCl2 + H2
b b
Zn + HCl = ZnCl2 + H2
c c
Gọi a,b,c lần lượt là số mol Mg,Fe,Zn. Theo đề bài VH2 do sắt tạo ra gấp 2 lần thể tích H2 do Mg tạo ra. Do đó b = 2a
Số mol khí H2 là : nH2 = 17,92/22,4 = 0,8
Ta có : ⎧⎨⎩24a+56b+65ca+b+cb=2a{24�+56�+65��+�+��=2� ⇒⎧⎨⎩a=0,1(mol)b=0,2(mol)c=0,5(mol)⇒{�=0,1(���)�=0,2(���)�=0,5(���)
Thành phần % khối lượng mỗi kim loại là :
%Mg=0,1.24.10046,1=5,2%%��=0,1.24.10046,1=5,2%
%Fe=0,2.56.10046,1=24,3%%��=0,2.56.10046,1=24,3%
%Zn=0,5.65.10046,1=70,5%

a. PTHH:
Cu + HCl ---x--->
Fe + 2HCl ---> FeCl2 + H2
Vậy chất rắn A là Cu.
b. Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{16,8}{30}.100\%=56\%\)
\(\%_{m_{Cu}}=100\%-56\%=44\%\%\)
c.
Theo PT: \(n_{FeCl_2}=n_{Fe}=0,3\left(mol\right)\)
=> \(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
d.
Ta có: \(m_{dd_{FeCl_2}}=100+16,8=116,8\left(g\right)\)
=> \(C_{\%_{FeCl_2}}=\dfrac{38,1}{116,8}.100\%=32,62\%\)
ta có Cu ko phản ứng với HCl
-> V khí là do Fe phản ứng hết tạo ra
Fe + 2HCl -> FeCl2 + H2
0,3 .............................0,3
n H2 = 6,72 : 22,4=0,3 mol
m Fe = 0,3.56 =16,8 g
% Fe = 16,8 : 30 .100 = 56 %
% Cu = 100% - 56% = 44%
nH2= 0,3(mol)
PTHH: Mg +2HCl -> MgCl2 + H2
x_______2x______x_______x(mol)
Zn +2 HCl -> ZnCl2 + H2
y____2y____y______y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+65y=11,3\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
=> m(muối)= mMgCl2+ mZnCl2= 95x+136y=95.0,2+136.0,1=32,6(g)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(\Rightarrow n_H=0,6mol=n_{HCl}\)
\(\Rightarrow m_{Cl}=0,6.35,5=21,3g\)
\(\Rightarrow m_M=m_{KL}+m_{Cl}=11,3+21,3=32,6g\)